Un nouvel outil dans la lutte contre les bactéries multirésistantes aux antibiotiques
Des scientifiques de France, d'Allemagne et d'Italie, en collaboration avec la ligne PROXIMA-2A, ont conçu une nouvelle classe de molécules, actives pour inhiber un des mécanismes majeurs impliqué dans le phénomène de multirésistance des bactéries aux antibiotiques (MDR). Ces résultats pourraient représenter une nouvelle stratégie de lutte contre ce fléau qu’est la MDR.
À l'ère pré-antibiotiques, une petite coupure au doigt pouvait entraîner une infection mortelle. En 1928 Sir Alexander Fleming découvre, de manière accidentelle, la pénicilline -ce qui lui valut le prix Nobel- et, depuis, ce médicament miracle a sauvé des millions de vies. Cependant, l'utilisation exagérée et à mauvais escient d'antibiotiques dans l'agriculture et l'aquaculture, ainsi que leur prescription excessive au public, a mis à mal leur efficacité en contribuant au développement et la dissémination de bactéries multirésistantes aux antibiotiques (MDR). L'Organisation mondiale de la santé annonce que les infections résistantes aux médicaments pourraient causer 10 millions de décès chaque année d'ici 2050.
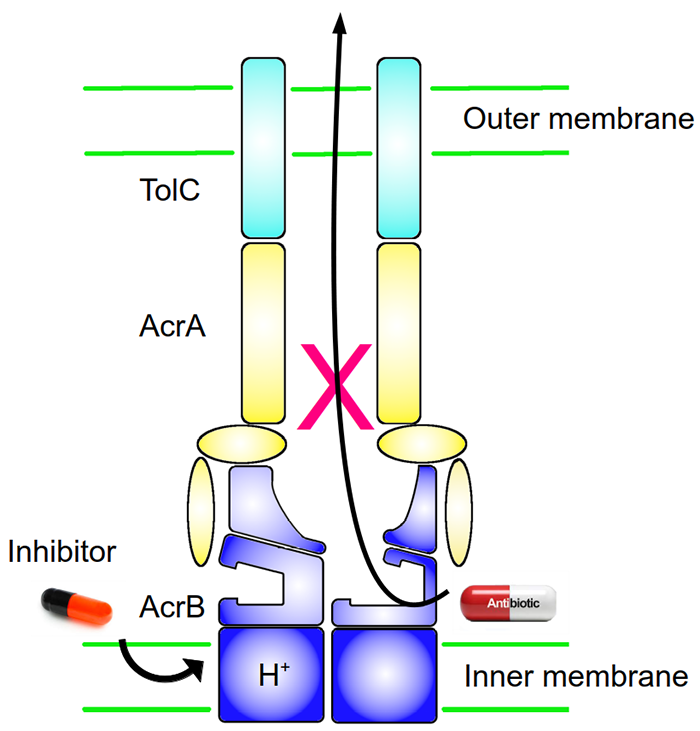
L'une des principales stratégies employées par les bactéries en présence d'antibiotiques est l’utilisation d’une « pompe d’efflux ». Formée de protéines localisées dans la ou les membrane(s) entourant la bactérie, cette pompe va, telle une sorte d’aspirateur, évacuer les substances toxiques présentes dans la bactérie, dont les antibiotiques. Cependant « l'aspiration » -le mécanisme de transport des antibiotiques hors de la bactérie- est un phénomène complexe. De nombreuses études ont montré que la pompe d'efflux « AcrAB-TolC » de la bactérie Escherichia coli – qui cause notamment la tourista, ou diarrhée du voyageur - utilise plusieurs "tuyaux" (voies de transport) différents pour aspirer les antibiotiques présents dans la bactérie, puis les transfère dans un "sac à poussière" : une poche de liaison, appelée ainsi car c’est là que se fixent notamment les antibiotiques. Enfin, ce sac à poussière est vidé : les antibiotiques sont expulsés.
Ces dernières années, la recherche visant à inhiber les pompes d’efflux s'est principalement concentrée sur cette poche de liaison, l’objectif étant de trouver des molécules susceptibles de s’y fixer à la place des antibiotiques, empêchant ainsi leur expulsion. Les scientifiques ont conçu plusieurs agents qui bloquent le "sac à poussière" (inhibiteurs) afin d'empêcher l'aspiration (transport des antibiotiques). Cependant, ces inhibiteurs n’ont pas été commercialisés en raison notamment de leur faible activité ou de leur toxicité.
Récemment, des scientifiques de l'Institut Pasteur de Lille, de la Goethe-Université de Francfort et de l'Université de Cagliari ont uni leurs forces pour concevoir des inhibiteurs qui agissent en coupant l'alimentation en énergie nécessaire au fonctionnement de « l’aspiration » des antibiotiques – cette énergie est fournie par la présence d’un gradient de protons dans la membrane de la bactérie. Initialement, 1280 composés ont été testés pour l'inhibition de l'AcrB, un système modèle pour l'étude des pompes d'efflux. Un seul composé s’est révélé efficace, mais il était peu actif. Puis, en se basant sur l’analyse de la relation structure-activité de ce composé, les scientifiques en ont synthétisé 11 autres. Pour comprendre leur fonctionnement, les scientifiques ont successivement ajouté la protéine AcrB à chaque nouvel inhibiteur. Ils ont ensuite déterminé la structure 3D du complexe pompe/inhibiteur formé, en utilisant la technique de cristallographie et diffraction des rayons X. Ces expériences ont été menées sur la ligne PROXIMA-2A à SOLEIL.
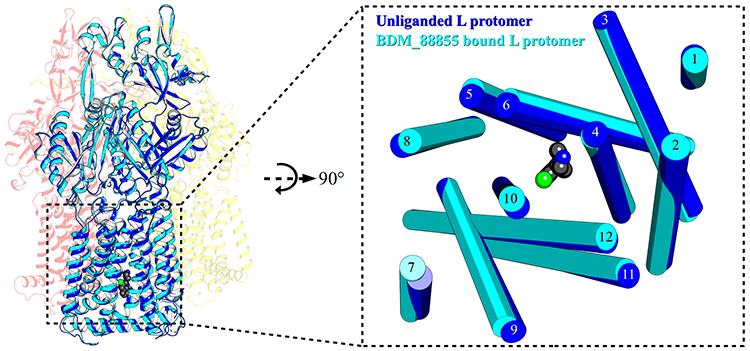
À gauche : structure 3D de la protéine AcrB liée à une molécule d’inhibiteur (au centre en bas du carré en pointillés, boules noires et verte), fixée dans la poche de liaison qui empêche la protonation.
À droite : zoom sur l’inhibiteur au centre de la poche.
L’analyse des données obtenues a permis de visualiser, à l’échelle atomique, où et comment se fixe l’inhibiteur sur la pompe et provoque la « coupure d'alimentation » lors de l’aspiration des antibiotiques. Les scientifiques ont ainsi démontré que ces inhibiteurs se lient à une poche jusqu'alors inconnue de la pompe AcrB, poche située dans la partie transmembranaire de la bactérie, à proximité du relais de protons qui alimente la pompe en énergie (cf figure 2). Ces résultats suggèrent que les inhibiteurs pourraient fonctionner soit en empêchant un changement de conformation de la pompe -nécessaire à son bon fonctionnement- soit en gênant le relais de protons, entrainant un dysfonctionnement du mécanisme d’expulsion des antibiotiques.
Ces découvertes constituent une nouvelle stratégie dans la lutte contre les bactéries multirésistantes aux antibiotiques.