Trois molécules d’eau suffisent à stabiliser un dipeptide
Des expériences menées sur la ligne DESIRS montrent que la nanosolvatation par seulement trois molécules d'eau d'un dimère peptidique fragile, isolé en phase gazeuse, a un effet considérable sur sa stabilité. La spectroscopie de masse a en effet permis d’observer une réduction drastique de l'abondance de fragmentation, par irradiation VUV, du précurseur du dimère protoné s’il est hydraté. Cette observation est bien reproduite par des calculs montrant que l'hydratation stabilise effectivement la structure du dimère. Des résultats publiés dans Angewandte Chemie.
La structure et la fonction des biomolécules sont intrinsèquement liées à leur environnement aqueux. Les chercheurs tentent depuis longtemps de comprendre l'effet de la couche de solvatation de l'eau environnante sur la conformation de biomolécules, ainsi que la manière dont cette couche de solvatation influence à la fois les propriétés fonctionnelles et la susceptibilité aux facteurs externes (tels que les rayonnements ionisants) des biomolécules. En particulier, le solvant joue un rôle clé dans les processus d'auto-assemblage ainsi que dans la formation et la stabilisation de complexes macromoléculaires.
La limite de solvatation : combien de molécules d'eau sont nécessaires pour produire un effet de stabilisation ?
Le besoin de mieux comprendre l'effet de la solvatation aqueuse sur la structure des protéines a conduit à un effort de recherche soutenu sur la solvatation graduelle de biomolécules : la notion de « limite de microsolvatation » (ou nanosolvatation), qui désigne un nombre réduit et bien défini de molécules d'eau liées, a été définie. Toutefois, les recherches expérimentales sur des espèces nanosolvatées dans des conditions précises présentent des difficultés.
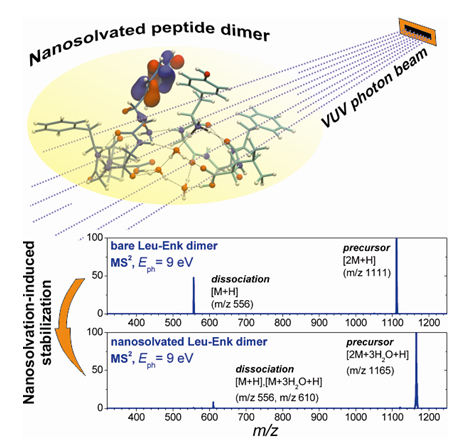
L’étude décrite ici porte sur une comparaison expérimentale et théorique entre le dimère peptidique leucine-encéphaline (Leu-Enk) protoné nu, et ce même système solvaté par trois molécules d'eau, qui présente déjà un effet net de nanosolvatation. Le dimère Leu-Enk est utilisé ici comme système modèle pour les interactions peptide-peptide, pertinent non seulement pour la formation de complexes non covalents mais aussi pour l'acquisition des structures secondaires et tertiaires des protéines.
Mesure de la fragmentation induite par irradiation VUV d'un dimère peptidique nu ou solvaté
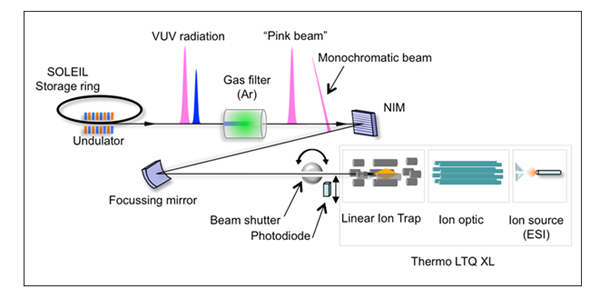
Le dispositif expérimental, développé récemment (réf. 1), consiste en un spectromètre de masse à piège à ions équipé d’une source électronébulisation, couplé à la ligne de lumière VUV DESIRS. Il a permis d'isoler en phase gazeuse un dimère protoné de Leu-Enk nu et un autre solvaté avec 3 molécules d'eau, puis de mesurer l'intensité de fragmentation photo-induite à différentes énergies incidentes.
Les résultats montrent que la dissociation du précurseur hydraté en monomères (figure 2), ainsi que le clivage de la chaîne peptidique, diminuent de façon drastique. Ceci traduit clairement une stabilisation considérable du système par l'ajout d'un très petit nombre de molécules d'eau.
De plus, la stabilité induite par la solvatation a été confirmée en détectant l'ion doublement chargé produit par photoionisation des espèces protonées hydratées, qui peuvent être préservées en phase gazeuse, ce qui a permis de déterminer précisément le seuil d'ionisation. L'augmentation apparente de stabilité sous irradiation VUV du complexe hydraté, en comparaison avec celle des espèces nues, est frappante et soulève la question du processus de dissipation d'énergie. En effet, la nanosolvatation est à l’origine de cette dissociation empêchée du dimère, même pour des irradiations à des énergies inférieures au seuil d'ionisation.
Les calculs confirment que l'hydratation stabilise la structure du dimère
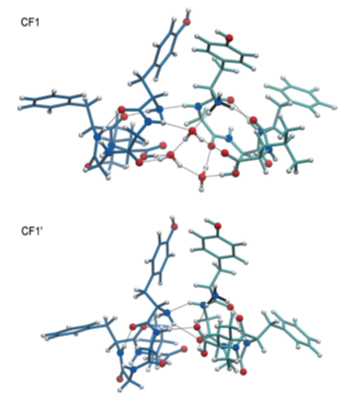
L’étude théorique de la structure du dimère peptidique nanosolvaté, par des calculs de dynamique moléculaire et de théorie de la fonctionnelle densité (DFT), ont confirmé ces résultats expérimentaux. Les calculs montrent que l'hydratation avec seulement 3 molécules d'eau ne modifie pas de manière significative la structure 3D du dimère (voir la figure 3), mais la stabilise d’environ 1,5 eV. En fait, le dimère est formé via des liaisons non covalentes (liaisons hydrogène), que ce soit en présence ou non de molécules d’eau. Toutefois, une comparaison des complexes nu et hydraté révèle que la liaison entre dimères est considérablement renforcée par la nanosolvatation, de par la capacité des molécules H20 à adapter leur position de « pontage » et leur orientation par rapport aux autres molécules, augmentant ainsi le nombre le nombre de liaisons hydrogène effectives.
Ces nouveaux résultats devront être pris en compte lors de l'évaluation de la stabilité de complexes non covalents de protéines ainsi que de la structure des protéines pour des ions isolés non hydratés, notamment par spectrométrie de masse. D'autre part, l'effet phénoménologique d'écran de la microsolvatation observé ici serait pertinent pour les recherches sur les dommages causés par le rayonnement (radiobiologie), et pourrait contribuer à acquérir une meilleure compréhension de ces processus au niveau moléculaire.
Référence :
1 - Milosavljević A R, Nicolas C, Gil J-F, Canon F, Réfrégiers M, Nahon L & Giuliani A
VUV synchrotron radiation: a new activation technique for tandem mass spectrometry
Journal of synchrotron radiation, 2012, 19 174–8