En combinant la thermométrie à l’échelle nanométrique avec l’imagerie cellulaire, des chercheurs ont montré comment la chaleur générée par des nanoparticules d’or soumises à une lumière proche de l’infrarouge se propage, depuis chaque nanoparticule jusqu’aux structures de cellules tumorales entières.
Sur la ligne de lumière SAMBA, la spectroscopie d’absorption X a permis aux scientifiques de mesurer sur des modèles tumoraux en 3D les changements de température se produisant à l'échelle atomique, et de comprendre comment ils provoquent des dommages cellulaires sur ces tumeurs.
Lorsqu’elles absorbent une lumière du proche infrarouge, les nanoparticules d’or en forme d’étoile (AuNS) la convertissent en chaleur capable de détruire les cellules cancéreuses. Les températures les plus élevées apparaissent à proximité immédiate de chaque nanoparticule, mais il est difficile de mesurer directement ces températures dans un tissu biologique et de les relier à de potentiels dommages thermiques au niveau cellulaire.
Une équipe internationale, menée par l’Institut des sciences des matériaux de Madrid (ICMM-CSIC, Espagne), l’Université Complutense de Madrid (Espagne), l’Institut Curie (France), l’IMDEA Nanociencia (Espagne), l’Institut de céramique et du verre (ICV-CSIC, Espagne), l’Université de Valladolid (Espagne) et le synchrotron SOLEIL, a associé la mesure de température à l’échelle nanométrique à une microscopie haute résolution pour suivre les effets thermiques à plusieurs échelles — depuis les atomes d’or jusqu’aux structures entières de modèles de cellules tumorales, les sphéroïdes1.
Sur la ligne de lumière SAMBA à SOLEIL, les chercheurs ont utilisé la spectroscopie EXAFS (Extended X-ray Absorption Fine Structure) pour suivre les vibrations atomiques dans les AuNS intégrés à des sphéroïdes tumoraux en 3D. En calibrant ces vibrations — quantifiées par le facteur de Debye–Waller — avec des températures connues, ils ont mis au point un « thermomètre nanométrique » précis.
Lorsqu’ils ont éclairé des sphéroïdes chargés en AuNS avec un laser à 808 nm, les données EXAFS ont montré que les températures locales à l’échelle nanométrique étaient plus élevées que celles enregistrées par les caméras infrarouges. Cela a confirmé l’existence de forts gradients thermiques dans l’environnement cellulaire, non détectables avec les mesures globales classiques.
Pour comprendre l’impact de ces pics thermiques sur les cellules, ces mêmes sphéroïdes ont été analysés en microscopie confocale. À échauffement modéré, la protéine d’adhésion cellulaire E-cadherine restait intacte, voire était renforcée, stabilisant potentiellement la structure tissulaire. En revanche, à plus forte température, le cytosquelette (F-actine) s’effondrait. Au-delà d’un certain seuil, les sphéroïdes perdaient leur viabilité et se désagrégeaient — une conséquence macroscopique claire d’un dommage thermique à l’échelle nanométrique.
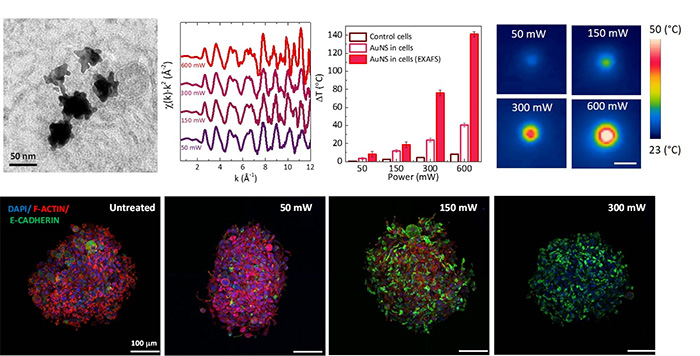
Figure 1 : Nanoparticules d’or pour l'analyse photothermique multi-échelle. En haut, de gauche à droite : l'imagerie par microscopie électronique à transmission montre la structure ramifiée des nano-étoiles d’or. La spectroscopie d'absorption des rayons X au seuil L3 de l'or (signal EXAFS) sous différentes puissances laser permet de calibrer les températures à l'échelle nanométrique. Les cartes thermiques confirment l'échauffement de la surface lorsque la puissance augmente. En bas : la microscopie confocale des sphéroïdes tumoraux (DAPI (colore les noyaux cellulaires), F-actine (cytosquelette), E-cadhérine (protéine d'adhésion)) relie ces pics de chaleur à l'effondrement du cytosquelette et à l'altération de l'adhésion cellulaire.
En reliant la montée en température à l’échelle nanométrique aux altérations structurales microscopiques et aux réponses tissulaires à l’échelle macroscopique, cette étude offre la première vision complète, multi-échelle, de la thérapie photothermique. Ces résultats ouvrent la voie à l’optimisation des conditions de traitement pour maximiser la destruction des cellules cancéreuses tout en préservant les tissus sains. Des travaux à venir viseront à étendre cette approche à d’autres nanomatériaux et modèles biologiques, en confirmant le rôle clé des techniques synchrotron à rayons X pour relier la nanophysique à la biologie cellulaire.
1- Sphéroïde : agrégat sphérique de cellules de glioblastome auto-assemblées, utilisé comme modèle in vitro de tumeur 3D.
