Supporter la pression sans perdre ses couleurs
La haute pression s’impose comme un outil puissant en biologie structurale, offrant un accès inédit aux états intermédiaires du repliement des protéines. Au Laboratoire Léon-Brillouin (Saclay), en collaboration avec l’Université de Belgrade (Serbie), des scientifiques ont étudié la stabilité de la R-phycocyanine (R-PC), une protéine d’algue à l’intense couleur violette, en combinant la diffusion des rayons X aux petits angles (SAXS) sous pression sur la ligne SWING à des mesures d’absorbance et de fluorescence.
Leurs analyses révèlent des transformations structurales majeures ainsi qu’une préservation partielle de la couleur la R-PC, contrairement à ce qui est observé après une dénaturation thermique. Cette étude ouvre ainsi de nouvelles perspectives pour l'utilisation de la R-PC comme colorant alimentaire naturel.
Un nouvel outil pour la biologie structurale
D'abord utilisée pour explorer les environnements extrêmes, la haute pression (HP) s'impose aujourd'hui comme un outil innovant en biologie structurale. Contrairement aux méthodes classiques de dénaturation thermique ou chimique, elle permet d’accéder à des états intermédiaires du repliement des protéines sans provoquer d’agrégation. Facteur thermodynamique clé, elle favorise les structures compactes et, appliquée modérément (jusqu’à 6000 bars ou 600 millions de pascals), met en lumière des conformations rares mais essentielles à l’activité des protéines. En parallèle, la HP, appelée aussi « pasteurisation à froid », s’est développée à l’échelle industrielle, offrant une alternative de conservation des aliments plus durable, en réduisant les coûts énergétiques, en évitant les additifs chimiques et en préservant l’intégrité des substances actives.
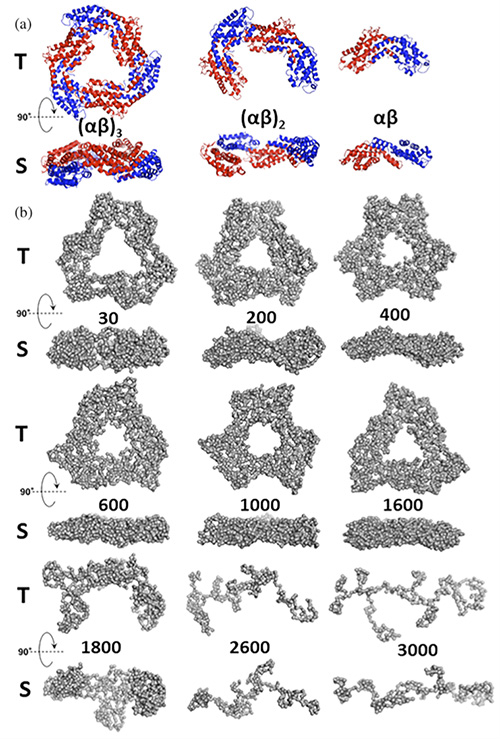
Cependant, malgré son immense potentiel, la HP reste encore peu exploitée en biologie structurale. Au Laboratoire Léon-Brillouin (LLB, UMR 12 CEA, CNRS, Université Paris-Saclay), des chercheurs explorent la stabilité des protéines sous pression en combinant la diffusion des rayons X ou des neutrons aux petits angles (SAXS/SANS) et la spectroscopie optique (absorbance, fluorescence). En collaboration avec l’Université de Belgrade (Serbie), sont présentés ici les premiers résultats obtenus par SAXS sur des macromolécules biologiques grâce à la cellule HP de la ligne SWING (Figure 1).
Décryptage de la stabilité de la R-phycocyanine sous pression
Cette étude porte sur les phycobiliprotéines (PBPs), des pigments naturels présents dans les algues, utilisées comme compléments alimentaires (spiruline) et colorants naturels. Parmi elles, la R-phycocyanine (R-PC), extraite d’algues rouges comestibles, se distingue par sa structure oligomérique et ses propriétés fluorescentes.
En combinant HP-SAXS, spectroscopie d’absorption dans le visible (HP-VIS) et fluorescence (HP-fluorescence), l’effet de la pression sur la stabilité de la R-PC a été analysé. Les résultats de HP-SAXS révèlent plusieurs transformations majeures : compression et aplatissement de la structure trimérique de la protéine, dissociation en monomères et dimères, allongement et dépliement progressif des monomères (Figure 2). Ces changements, confirmés par HP-VIS et HP-fluorescence, soulignent l’importance de ces techniques pour explorer le comportement des PBPs sous pression.
Renaturation et applications potentielles
Lors de la dépressurisation (de 4,000 bars jusqu’à la pression atmosphérique), une renaturation partielle est observée, mais sans restauration complète de l’état natif trimérique. Un mélange de monomères et de dimères persiste, accompagné d’une augmentation des feuillets β au détriment des hélices α. Toutefois, la HP préserve mieux la couleur de la R-PC qu’un chauffage à 60°C, maintenant ainsi ses propriétés optiques pour une utilisation comme colorant alimentaire naturel.
Cette étude offre un nouvel éclairage sur le dépliement et la stabilité des PBPs sous pression, ouvrant la voie à des stratégies innovantes pour leur conservation et leur valorisation comme colorants naturels. Déjà exploitée industriellement pour la conservation des aliments, la HP pourrait ainsi trouver de nouvelles applications dans l’agroalimentaire. Des recherches futures exploreront l’effet de différents ligands alimentaires, notamment les sucres, sur la renaturation complète de la R-PC. Ces résultats seront également comparés à ceux obtenus sur la C-phycocyanine (C-PC), qui fera l’objet d’une prochaine publication scientifique.