Recherche d’alternatives aux opioïdes : Des nanoparticules de promédicaments analgésiques étudiées sur SWING et DISCO
La crise des opioïdes constitue aujourd'hui un défi majeur pour la santé mondiale. Les opioïdes sont les analgésiques les plus puissants et les plus largement utilisés, mais ils présentent de graves risques d'accoutumance. Dans ce contexte, une approche révolutionnaire de nano-médecine a été proposée par l’Institut Galien, basée sur des promédicaments* constitués d’une molécule à l’action analgésique liée à un groupement chimique protecteur, qui s’auto-assemblent spontanément en nanoparticules.
Des scientifiques de l'Institut Galien (Université Paris-Saclay) et du NIMBE (CEA/CNRS) ont étudié les caractéristiques physico-chimiques de trois promédicaments possédant des profils analgésiques différents. Ils ont découvert que modifier la partie liant molécule active et groupement protecteur induisait des différences significatives dans la structure des nanoparticules de promédicaments formées, et dans leurs interactions avec l'albumine, une protéine sanguine modèle.
Les nanotechnologies représentent une approche de choix pour l'administration ciblée, la libération contrôlée et la protection contre la métabolisation rapide des médicaments. Cependant, si la recherche dans le domaine des nanomédicaments a été très active au cours des 20 dernières années, apportant des percées inattendues (le vaccin COVID n'étant pas la moindre), le passage de la paillasse à la clinique reste un défi. En effet, malgré leur efficacité prouvée, plusieurs aspects du mécanisme d'action des médicaments restent mal compris.
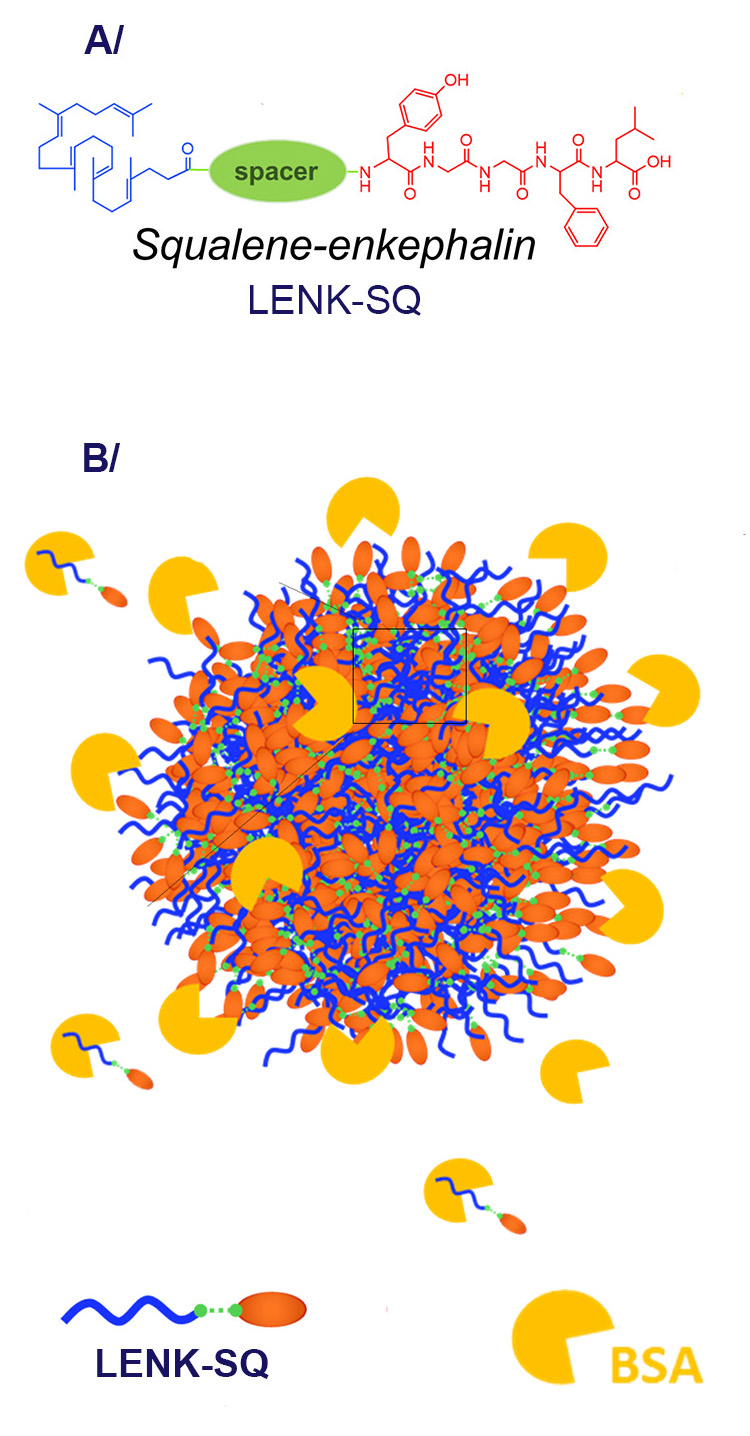
C'est notamment le cas des LENK-SQ, des promédicaments* dont l’activité analgésique est difficilement prévisible. Les LENK-SQ résultent du couplage entre une molécule active : la leu-enképhaline "LENK", un neuropeptide endogène connu pour être rapidement dégradé et métabolisé, et le squalène "SQ", un lipide naturel et biocompatible. Les bioconjugués LENK-SQ obtenus ont montré une capacité à s'auto-assembler spontanément dans l'eau pour former des nanoparticules (NP) d'un diamètre de l'ordre de 100 nm. Ces NPs à base de squalène permettent alors de protéger la LENK et d’obtenir un meilleur ciblage in vivo des cellules à traiter, améliorant ainsi l’activité pharmacologique et réduisant la toxicité et les effets secondaires du LENK.
Trois bioconjugués LENK-SQ différents ont été obtenus par des scientifiques de l’Institut Galien en modifiant le groupement chimique (« spacer » sur la figure 1) liant le neuropeptide et le squalène, spacer noté Am, Dig ou Acyl, ceci afin de moduler la libération et les profils analgésiques de la Leu-enképhaline.
Si administrer les bioconjugués LENK-SQ sous la forme de NPs a donné des résultats prometteurs, un aspect important reste mal compris : la variabilité des profils analgésiques entre les trois types de nano-assemblages. Ces résultats inattendus étaient difficiles à expliquer et n'étaient pas liés à des considérations purement moléculaires.
Estimant qu'une meilleure compréhension des propriétés physico-chimiques de ces nanoobjets complexes permettrait de mieux prédire et comprendre leur comportement in vivo et mettre en évidence certains points faibles (tels que la reproductibilité de la formulation, les problèmes d'agrégation, etc.) les chercheurs de l'Institut Galien, en collaboration avec des scientifiques du NIMBE, ont étudié l'organisation supramoléculaire de ces NPs et leur interaction avec les protéines du plasma sanguin en relation avec leur activité analgésique.
(A) Formule simplifiée de promédicament LENK-SQ dont trois types ont été étudiés, différant par le groupement chimique (noté « spacer ») entre Squalène et Leu-enképhaline.
(B) Schéma de l'interaction entre une nanoparticule sphérique formée de bioconjugués LENK-SQ et la protéine sanguine modèle BSA.
Les chercheurs du NIMBE (CEA/CNRS) ont développé une méthodologie pour analyser les structures supramoléculaires des nano-assemblages obtenus et tester les interactions nanoparticules-protéines en utilisant la BSA (sérum albumine bovine) comme protéine modèle, l'albumine étant le composant protéique majeur du sang (figure 1B).
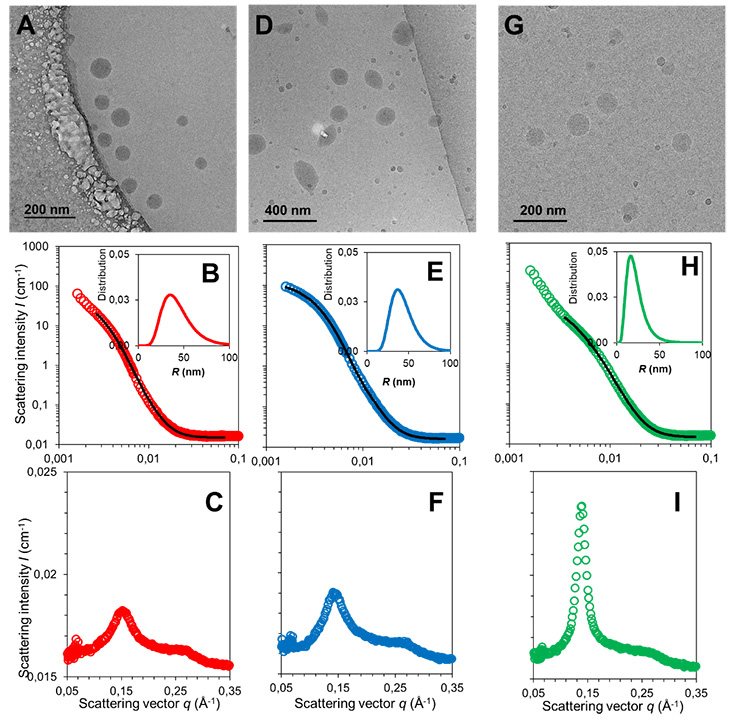
Pour ce faire, ils ont combiné la microscopie électronique à transmission cryogénique (cryoTEM), la diffusion des rayons X aux petits et grands angles (SAXS-WAXS), la diffusion des neutrons aux petits angles (SANS) et le dichroïsme circulaire du rayonnement synchrotron (SRCD). Les analyses SAXS-WAXS et SRCD ont été réalisées à SOLEIL, respectivement sur les lignes de lumière SWING et DISCO.
Les techniques combinées SAXS/WAXS et SANS permettent d'analyser la distribution des tailles et la structure interne des nanoparticules pour un grand ensemble de particules organiques (plus de 1010). Alors que l’analyse SANS est traditionnellement préférée pour étudier des suspensions organiques faiblement concentrées dans de l'eau deutérée, en raison de la grande sensibilité entre l'hydrogène des nanoparticules et le deutérium du solvant, les analyses SAXS/WAXS fournissent des indications utiles sur la structure interne des nanoparticules grâce à leur meilleure résolution.
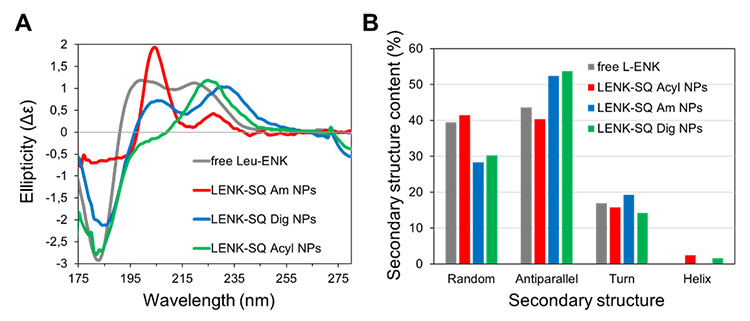
Les résultats obtenus montrent qu'un petit changement dans la nature de la liaison entre le peptide et le groupement squalène conduit à des différences de distributions de taille, de charges et de structures internes des NPs. Les spectres SRCD montrent que si la conformation globale du médicament est conservée dans les NPs, dans certains cas elle peut être impliquée dans la structure par le biais d'une participation aux liaisons hydrogène.
(A) Spectres de dichroïsme circulaire par rayonnement synchrotron des trois suspensions de NPs et spectre de LENK libre en solution (2 mg/mL).
(B) Analyse de la structure secondaire des peptides.
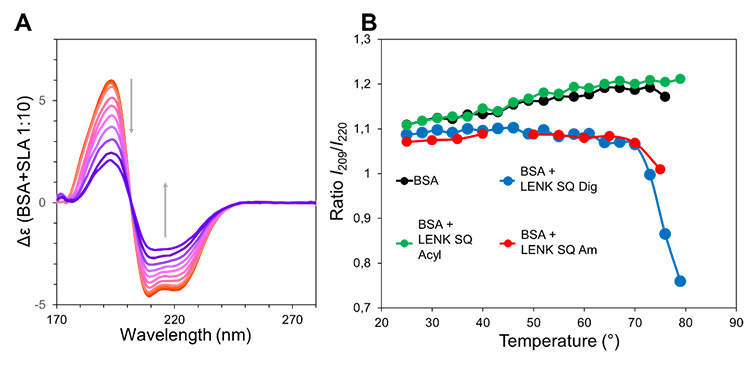
En ce qui concerne l'interaction des NPs avec la BSA, les spectres SAXS et SANS montrent une diminution du signal de diffusion des NPs, pouvant s’expliquer par un mécanisme de désassemblage, d’une ampleur différente en fonction de la nature du spacer. Les analyses SRCD de la conformation de la BSA en présence des NPs confirment qu'une légère interaction existe entre la protéine et le promédicament, ce qui suggère la formation d'un complexe.
(A) Suivi par SRCD de la dénaturation thermique de la BSA en présence d'un excès de NPs de LENK-SQ Am.
(B) Représentation graphique du rapport d'intensité CD à 209 et 220 nm pendant la dénaturation thermique de la BSA en solution et en présence des NPs LENK-SQ Am, Dig et Acyl, respectivement.
En conclusion, des caractéristiques physico-chimiques différentes des trois promédicaments formant les NPs ont été observées, qui pourraient être liées aux différences d’activité pharmacologique précédemment observées. Toutefois, des études supplémentaires sont nécessaires pour démontrer une véritable causalité.
Cette première étude indique des observations essentiellement qualitatives qui seront ultérieurement renforcées par des analyses quantitatives combinées à des études théoriques afin de mieux décrire l'interaction entre les protéines et les NPs de promédicaments. Néanmoins, cette étude confirme que des analyses physico-chimiques des suspensions de Nps ne peuvent être négligées dans une démarche de déchiffrage des mécanismes d'action des nanomédicaments.
-----------------------------------------------------
* promédicament : médicament administré sous une forme inactive, qui devient actif après transformation (par réaction chimique, le plus souvent effectuée par des enzymes) in vivo. Ici la transformation est la libération de la partie LENK par coupure de LENK-SQ au niveau du spacer.