Première structure de la protéine pathogène huntingtine et lien avec la maladie de Huntington
La maladie de Huntington (MH) est une pathologie neurodégénérative mortelle qui se développe lorsque l’organisme produit la protéine appelée huntingtine sous une forme possédant un trop grand nombre (plus de 35) d’acides aminés de type glutamine à l’une de ses extrémités. Quels sont les changements subis par la huntingtine lorsque ce seuil de 35 glutamines est dépassé, provoquant la maladie ?
En combinant un ensemble d'outils biophysiques, des scientifiques du Centre de Biologie Structurale (CBS, Montpellier) ont déterminé la structure 3D de cette protéine : c’est un équilibre de longues conformations partiellement hélicoïdales. La stabilité de ces hélices définit la capacité de la protéine à s'agréger et à former des inclusions dans les cellules, qui sont à l'origine de la MH.
La maladie de Huntington (MH) est une maladie neurodégénérative mortelle causée par une expansion d’une partie du gène nommé HTT (pour huntingtine). Lorsque cette partie de gène (httex1) est traduite, si elle possède une telle expansion cela donne alors une protéine huntingtine se terminant par une longue succession d’acides aminés glutamine (poly-Q) à l’une des extrémités, dite N-terminale. Seules les personnes ayant une succession de plus de 35 glutamines consécutives développent la MH. Les changements structuraux qui interviennent dans la partie httex1 lorsque sa longueur dépasse ce seuil pathologique de 35 glutamines restent mal connus, ce qui empêche de comprendre la pathologie sur le plan moléculaire.
L'étude structurale à haute résolution de httex1 avait jusqu’alors été considérée comme impossible en raison de sa flexibilité intrinsèque, qui exclut l'utilisation de la cristallographie aux rayons X et de la cryo-microscopie électronique, et à cause du fort biais de composition qui entrave l'utilisation des approches RMN traditionnelles.
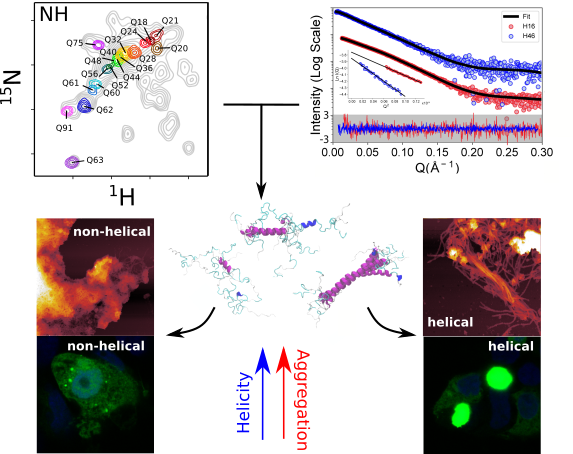
Au cours de ces dernières années, le groupe « Protéines hautement flexibles » dirigé par Pau Bernadó au Centre de Biologie Structurale (CBS) de Montpellier a développé de nouvelles approches de biologie chimique pour marquer des zones spécifiques des protéines avec des acides aminés « lourds » (incorporation dans la protéine d’isotopes lourds – mais non radioactifs- de certains atomes, comme le 13C pour remplacer le 12C), permettant l'étude par la technique de Résonance Magnétique Nucléaire (RMN) à haute résolution de protéines présentant de longues séquences répétitives, telles que httex1.
L'utilisation systématique d’un tel marquage isotopique a permis la caractérisation structurale des séquences poly-Q de versions pathogènes de httex1 ayant 46 et 66 glutamines consécutives. Les informations dérivées de la RMN, qui rendent compte de la structure locale, ont été complétées par des données de diffusion des rayons X aux petits angles (SAXS) obtenues sur la ligne de lumière SWING, qui quant à elles rendent compte de la forme globale de la protéine en solution.
L'intégration de ces données structurales dans des approches informatiques développées au laboratoire LAAS de Toulouse par Juan Cortés a permis d'obtenir pour la première fois un modèle structural d'une version pathogène de la huntingtine avant agrégation.
L’analyse des scientifiques révèle que la partie poly-Q adopte de longues conformations α-hélicoïdales stabilisées par des liaisons hydrogène entre les chaînes latérales des glutamines et le squelette carboné, et souligne l'importance des acides aminés qui encadrent cette partie poly-Q dans la définition de cette structure. En collaboration avec le groupe de Pierre-Emmanuel Milhiet (CBS-Montpellier), les scientifiques ont montré que la stabilité des hélices-α est une signature plus forte que le nombre de glutamines pour définir la cinétique d'agrégation, à la fois in vitro et dans les cellules, ainsi que la structure des fibrilles résultantes observée par microscopie à force atomique.
Ces observations offrent une perspective structurale de la pathogénicité de l'expansion de httex1 dans la MH et ouvrent la voie à une compréhension plus approfondie d'autres maladies liées à l'expansion poly-Q dans certains gènes humains, comme l’ataxie spinocérébelleuse, la maladie de Kennedy ou la maladie de Machado-Joseph.