Médicaments anticancéreux innovants : Découverte de nouveaux inhibiteurs de MDM2, protéine impliquée dans la prolifération cellulaire
L'immortalité des cellules cancéreuses, associée à la perte des mécanismes de contrôle de vie et mort cellulaire, tels que la régulation de l'apoptose (« mort cellulaire programmée »), est un stade récurrent dans l’évolution des tumeurs. Les mitochondries jouent un rôle important dans la régulation de l'apoptose en contrôlant la perméabilisation de leur membrane. Ce processus s’effectue par le biais de protéines présentes dans la membrane interne des mitochondries : des pores (« mitochondrial permeability transition pore » ; MPTP) dont l’ouverture provoque la libération de facteurs protéiques solubles induisant la mort cellulaire.
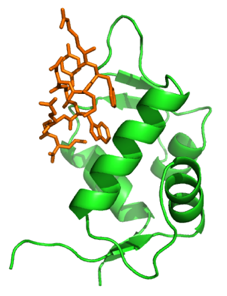
La protéine suppressive de tumeur p53 est un facteur de transcription* (*étape de synthèse d’ARN à partir d’ADN : ensuite l’ARN est traduit en protéines) qui favorise l'apoptose cellulaire en provoquant l’ouverture du MPTP en réponse au stress. Une autre protéine, appelée Murine Double Minute 2 (MDM2), inhibe p53 en se liant à son domaine de transactivation et en entravant l’activation de la transcription (Figure 1).
Il est bien connu que la surexpression (forte production) de MDM2 inhibe la fonction de la p53, conduisant à une prolifération cellulaire non contrôlée et au cancer. Par conséquent, de petites molécules ayant une action antagoniste de celle de MDM2 vont empêcher la fixation de M2D2 sur p53 en bloquant la zone où M2D2 interagit normalement avec p53, permettant de restaurer la fonction de cette dernière ; de telles molécules représentent donc une approche prometteuse pour le traitement du cancer.
Au cours de ces dernières années, des efforts importants ont été déployés dans le monde entier pour développer de petites molécules de ce type, antagonistes de MDM2.
Ainsi, un grand nombre de composés qui se lient fortement à MDM2 et détruisent efficacement les cellules cancéreuses in vitro et in vivo a été découvert. L’un des plus prometteurs est Nutlin3a. Cependant, la toxicité de ces molécules limite régulièrement leur application en clinique.
A partir du criblage virtuel de leur bibliothèque de composés chimiques, le groupe du professeur Rossello, du département de pharmacie de l’Université de Pise (Italie), a développé de nouvelles classes de petites molécules qui agissent comme des antagonistes puissants de MDM2. En outre, ces composés présentent de meilleures propriétés biopharmacologiques que les médicaments anticancéreux de référence tels que le Nutlin. Cependant, aucune information structurale n'est disponible à ce jour pour élucider leur fonctionnement au niveau atomique.
La collaboration entre le groupe du professeur Rossello et la ligne de lumière PROXIMA-1 de SOLEIL vise à déterminer la structure 3D de MDM2 liée à plusieurs nouveaux inhibiteurs, par diffraction aux rayons X de cristaux de tels complexes de MDM2/inhibiteur. Ces structures permettront de mieux comprendre le mécanisme moléculaire sous-jacent à l'inhibition de MDM2 et guideront la conception de médicaments anti-cancéreux plus efficaces et sélectifs.
Équipe de Recherche :
Armando Rossello, Elisabetta Orlandini, Elisa Nuti, Susanna Nencetti, Caterina Camodeca, Doretta Cuffaro, ("ProInLab", Departement. of Pharmacy, University of Pisa (UniPi))
Carole Fruchart-Gaillard (CEA, Institut des sciences du vivant Frédéric Joliot, Université Paris-Saclay, Service d’Ingénierie Moléculaire des Protéines)
Lidia Ciccone (Ligne de lumière Proxima-2A, Synchrotron SOLEIL)
Serena Sirigu (Ligne de lumière Proxima-1, Synchrotron SOLEIL)