Mécanisme moléculaire de la régulation du cholestérol LDL
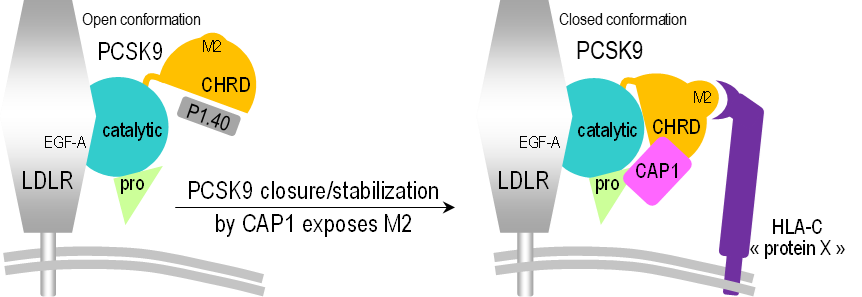
Dans une étape cruciale vers la compréhension des mécanismes relatifs aux maladies cardiovasculaires et à certains cancers, une équipe de recherche a réussi une première mondiale : trouver le mécanisme moléculaire par lequel la protéine PCSK9 dégrade les récepteurs des LDL -lipoprotéines de basse densité- ces molécules qui, dans le sang, transportent le cholestérol vers les cellules qui l’utilisent. La dégradation des récepteurs des LDL conduit à une augmentation du taux sanguin de LDL-cholestérol qui sont les particules de cholestérol les plus abondantes dans le sang. Or, cette dégradation par PCSK9 peut être inhibée grâce à un mini anticorps (nanobody) nommé P1.40.
L’utilisation de tels inhibiteurs thérapeutiques pourrait réduire les risques d'athérosclérose et de maladies cardiaques.
Malgré sa mauvaise réputation le cholestérol est une molécule, de la famille des lipides, indispensable à notre organisme : rôle dans la propagation de l’influx nerveux, composant des membranes cellulaires, précurseur d’hormones et vitamines… le cholestérol est essentiel. Son transport dans le sang est assuré par plusieurs types de molécules de la famille des lipoprotéines. Les lipoprotéines de haute densité (ou HDL : high-density lipoprotein) se chargent du cholestérol qui a été « utilisé », c’est-à-dire oxydé, et le ramènent depuis les artères ou les tissus vers le foie, où il est dégradé ; c’est ce que l’on désigne par « bon » cholestérol.
Les lipoprotéines de basse densité (ou LDL : low-density lipoprotein) transportent quant à elles le cholestérol depuis les tissus où il est sécrété -foie et intestin principalement- vers les cellules de l'organisme qui en ont besoin. Une accumulation des LDL dans le sang peut entraîner athérosclérose et maladies cardiaques – d’où le nom de « mauvais cholestérol » pour les LDL.
À la surface des cellules qui ont besoin de cholestérol se trouvent des récepteurs auxquels se fixent les LDL avant de pénétrer dans les cellules où le cholestérol est utilisé. Une fois les LDL dans la cellule, les récepteurs reviennent à la surface cellulaire pour continuer à y assurer leur fonction.
Si, du fait d’un dysfonctionnement, les LDL ne sont pas captées par les cellules, elles vont s’accumuler dans le sang avec les risques cités plus haut. Un tel dysfonctionnement peut provenir d’un problème des récepteurs des LDL ou, dans certains cas, d’une protéine appelée PCSK9.
Sécrétée dans le sang par le foie, PCSK9 favorise la dégradation des récepteurs des LDL par les cellules du foie. Une « suractivité » de la PCSK9 a pour conséquence de diminuer le nombre de récepteurs fonctionnels à la surface des cellules, donc la quantité de LDL captés, faisant augmenter le taux de LDL dans le sang. Certaines hypercholestérolémies sont ainsi dues à la présence de PCSK9 trop actives ; cette protéine est donc un sujet de choix pour les recherches sur ce type de pathologies.
Carole Fruchart Gaillard et ses collègues du département des médicaments et des technologies pour la santé (CEA/UPSaclay, Gif-sur-Yvette) ainsi que des scientifiques de l'Unité de recherche en biochimie neuroendocrinienne (IRCM, Montréal), du département de pharmacie de l'Université de Pise en Italie et des lignes SWING et PROXIMA-1 à SOLEIL, ont étudié le mécanisme jusque-là incompris, impliquant PCSK9, qui conduit à la dégradation des récepteurs des LDL.
Dans cette étude ils ont notamment utilisé une petite protéine de synthèse appelée P1.40 qui, lors de précédentes études, a révélé un rôle d’inhibition de la dégradation de PCSK9. En utilisant la diffusion X aux petits angles sur la ligne SWING, un changement structural de la protéine PCSK9 en solution a été observé, qui dépend de la présence ou non de P1.40. Celle-ci s’insère entre deux zones de PCSK9 (appelées domaine CHRD et domaine catalytique), empêchant ainsi PCSK9 de prendre sa forme active.
Sur la ligne PROXIMA-1 les détails de ce mécanisme d’inhibition ont pu être précisés grâce à une étude par diffraction X sur des cristaux de l’assemblage CHRD/P1.40. Cette étude a permis de déterminer la structure 3D de CHRD/P1.40 à une résolution atomique.
Leurs travaux portent également sur d’autres molécules actrices dans le processus de dégradation des récepteurs des LDL. L’une d’elles est une protéine clé du système immunitaire, HLA-C, qui s'est avérée jouer un rôle essentiel : liée à d’autres protéines, dont la PCSK9, elle dirige le récepteur vers les lysosomes qui vont dégrader l’ensemble de ces différentes protéines.
Inhiber la PCSK9 empêcherait alors la dégradation des différentes protéines liées (cf ci-dessus), ce qui augmenterait alors la quantité de HLA-C à la surface des cellules. Or HLA-C permet la reconnaissance du « soi » et stimule l'activité antitumorale des lymphocytes T, d’où un effet protecteur de l’inhibition de PCSK9 contre la croissance de tumeurs et des métastases associées.
À terme, l'espoir est de pouvoir élaborer des inhibiteurs qui empêcheraient l'interaction de PCSK9 et de HLA-C et bloqueraient la fonction de PCSK9 sur les LDLR et HLA-C.
Cette percée pourrait alors être appliquée pour traiter les maladies cardiovasculaires ainsi que divers types de cancers et de métastases.