Ligne DESIRS - Dynamique d'ouverture de cycle du radical et du cation cyclopropyle
Les cycles sont l'un des principaux moyens par lesquels les molécules construisent des structures tridimensionnelles. Leurs propriétés et leur dynamique sont donc d'une importance capitale dans de nombreux domaines chimiques. La caractérisation de la géométrie triangulaire et de la contrainte inhérente intense associée à la molécule de cyclopropyle (C3H5), l'un des motifs moléculaires cycliques les plus petits, simples et fondamentaux, intrigue donc les chimistes depuis plus d'un siècle. Les réponses aux questions sur la stabilité de cette molécule cyclique, sous forme de radical ou de cation, ont des implications pour la compréhension physique du comportement moléculaire et des applications en synthèse organique moderne.
Cette étude a pour but de répondre aux questions concernant la stabilité cinétique et thermodynamique du radical* et du cation cyclopropyle. En raison de la réactivité et de l'instabilité du radical cyclopropyle, il existait peu d’études expérimentales antérieures et, parmi celles-ci, seule une étude par spectroscopie de photoélectron avait un rapport direct avec les questions thermodynamiques et cinétiques en jeu ici. Pour attaquer ce problème avec des méthodes modernes, il était idéal de combiner l’utilisation de plusieurs dispositifs expérimentaux existant à SOLEIL : un réacteur d'abstraction d'atomes de Fluor permettant de générer des radicaux libres, le rayonnement ultraviolet sous vide (VUV) synchrotron de la ligne DESIRS et le spectromètre de coïncidence photoion-photoélectron à double imagerie DELICIOUS3 (i2-PEPICO).
Après avoir été produits dans le réacteur, les radicaux C3H5. —avec d’autres produits secondaires —sont ensuite soumis au rayonnement VUV de la ligne DESIRS, qui provoquent leur ionisation, on parle donc de photoionisation : C3H5. -> C3H5+ + électron.
Les différentes espèces chimiques présentes sont alors analysées grâce à un spectromètre de coïncidence par imagerie d’électrons et d’ions (i2-PEPICO), qui associe à chacune des espèces les spectres d’émission de photoélectrons qui leur correspondent.
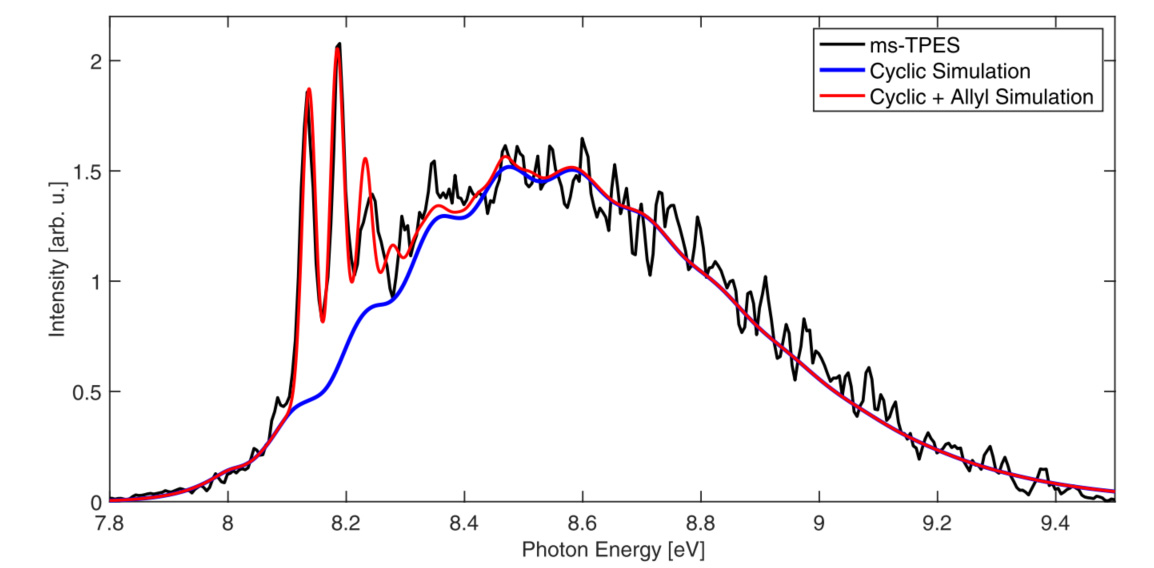
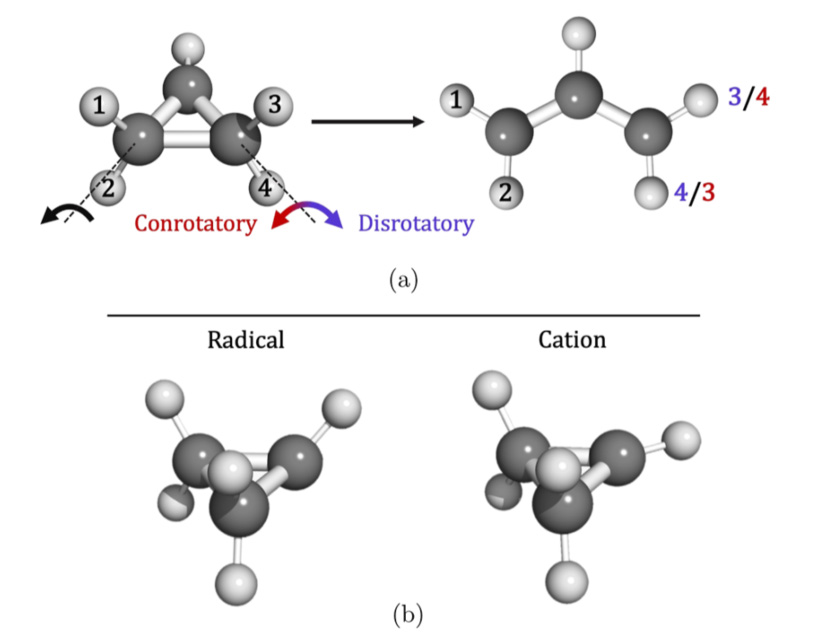
Par ailleurs les scientifiques ont, grâce à des calculs innovants basés sur la propagation des paquets d’onde vibrationnels dans les surfaces d’énergie potentielle du cation, modélisé les spectres théoriques d’émission de photoélectrons attendus pour le cation cyclopropyle, mais aussi sa forme linéaire (allyle) qui est produite par ouverture du cycle (figure 2).
Ces résultats expérimentaux et théoriques ont été obtenus grâce à une collaboration entre des scientifiques de l'Université Ben-Gurion du Néguev, du Harvard-Smithsonian Center for Astrophysics, de l'Institut des Sciences Moléculaires d'Orsay, de l'Université Bordeaux, de l'Université de Floride - Gainesville, de l'Argonne National Laboratory et de la ligne DESIRS.
La comparaison expérience / théorie a fourni des valeurs affinées de l'énergie de dissociation de la liaison C–H dans le cyclopropane et des énergies de cyclisation des radicaux et des cations cyclopropyles, entre autres grandeurs thermochimiques importantes.
L'accord étroit entre l'expérience et la théorie a aussi permis de conclure sans ambiguïté que la forme cyclique du cation n'existe en fait pas en tant qu'espèce stable, mais qu'il s'agit plutôt d'un état de transition vers le cation linéaire. Ainsi, le radical cyclopropyle existe en raison des barrières cinétiques à l’ouverture du cycle, qui ne sont pas présentes dans l’ouverture disrotatoire du cation (voir figure 3), ce qui règle une question fondamentale remontant aux premières théories des réactions péricycliques (réactions au cours desquelles une molécule passe par un état de transition en ayant une géométrie cyclique).
* radical libre (ou radical) : espèce chimique possédant un ou plusieurs électrons non appariés sur sa couche électronique externe – chaque électron non apparié est noté par un point. La présence de cet (ou ces) électron(s) confère souvent une grande instabilité au radical, qui a une durée de vie très courte et peut réagir avec de nombreux composés dans des processus le plus souvent non spécifiques.