La stabilité accrue de protéines mutantes à l’origine de maladies neurodégénératives ?
Des scientifiques du Groupe de Biophysique Moléculaire à l’Université de Liverpool ont découvert que la stabilité d’une protéine spécifique pouvait contribuer à la survenue de maladies neurodégénératives.
Cette protéine, TDP-43, est impliquée dans la fabrication d’autres protéines dans la cellule par l’intermédiaire de son interaction avec l’ARN. TDP-43 se lie à l’ARN, élément au cœur du processus de lecture de l’information contenue dans l’ADN, et de son utilisation pour produire des protéines. TDP-43 a été reliée à de nombreux troubles neurodégénératifs, comme la démence associée à Alzheimer ou à Parkinson, et représente un réel enjeu d’étude. En particulier, certaines mutations de TDP-43 sont liées à la maladie du motoneurone, ou à la dégénérescence lobaire fronto-temporale. La maladie du motoneurone concerne à elle seule environ 1 personne sur 1000, ce qui est comparable à la sclérose en plaques.
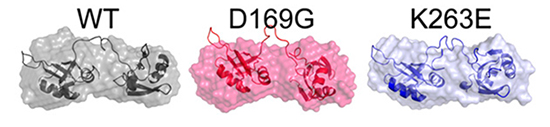
Les chercheurs de l’Université de Liverpool en Grande-Bretagne et de l’Université de Nagoya au Japon ont réalisé les premières études de structure moléculaire de certaines de ces mutations, arrivant à la conclusion qu’elles augmentaient la stabilité de TDP-43. Son taux de dégradation s’en trouve réduit, facteur connu comme indiquant l’âge à partir duquel les malades du motoneurone commencent à présenter des symptômes. Plus la TDP-43 des patients reste longtemps dans leurs cellules, plus la maladie survient tôt.
Les informations structurales ont été obtenues sur les lignes de lumière SWING et DISCO de SOLEIL, qui ont permis d’obtenir de nombreuses données par diffraction des rayons X aux petits angles et dichroïsme circulaire. Le professeur Hasnain, coauteur de cette étude, confirme que ces données ont été essentielles: « Ces données nous ont aidés à démontrer que l’augmentation de la demi-vie de TDP-43 mutées au niveau de deux domaines impliqués dans la liaison entre la protéine et l’ARN découlait d’une stabilité structurale et d’une résistance à l’agrégation accrues. »
Ces modifications de laTDP-43 sont inhabituelles, car la plupart des protéines impliquées dans les troubles neurodégénératifs sont instables. C’est le cas notamment pour la maladie d’Alzheimer, de Parkinson ou de Huntington ou même pour la maladie du motoneurone qui résulte de mutations sur une autre protéine, la superoxyde dismutase.
Les principaux auteurs de l’étude James Austin et le docteur Gareth Wright témoignent :
« Le fait que TDP-43 soit associé à de nombreuses maladies neurodégénératives justifiait nos investigations. Nous avons pu déterminer la structure, la demi-vie, le degré d’agrégation et la stabilité de la protéine. Nous avons identifié que la longévité cellulaire de TDP-43 est liée à une plus grande stabilité thermale, et à une résistance au dépliement. » « Stabilité thermale » signifie ici que la protéine est relativement rigide, elle se déplie à une température supérieure à celle de la forme non mutée (le repliement et le dépliement des protéines sont des processus centraux pour leurs interactions entre elles ou avec d’autres molécules) . Ceci provoque l’accumulation de TDP-43 dans la cellule, les taux de production et de disparition de la protéine ne sont plus identiques à ceux d’une cellule saine. Les auteurs ajoutent que cette modification du métabolisme mène finalement à la mort du neurone, cellule naturellement déjà fragile.
Ces découvertes ouvrent la voie à de plus amples recherches, comme le développement de médicaments qui réduisent la stabilité de TDP-43 et accélèrent sa dégradation. Le professeur Samar Hasnain, et le docteur Svetlana Antonyuk remercient le soutien sur le long terme de l’Association de la maladie du motoneurone.
Cette étude a été publiée dans le journal PNAS.