IrO2 le meilleur électrocatalyseur pour produire de l’hydrogène « vert » ? Oui, mais pas dans n’importe quel état !
L’oxyde d’iridium IrO2 est le catalyseur-clé pour produire de l’hydrogène « vert » par électrolyse de l’eau en milieu acide, mais il est très rare et cher. Afin d’optimiser son utilisation comme électrocatalyseur, il est crucial de mieux comprendre les relations structures-propriétés au sein de ce matériau. Grâce à des mesures d’absorption X en mode operando (ligne SAMBA) effectuées sur des oxydes mixtes iridium-molybdène, il a été mis en évidence que la structure cristallographique du matériau -état « pseudo-amorphe »- prime sur le degré d’oxydation de l’iridium pour expliquer son activité ; cette structure conduit à une activité bien meilleure que celle de matériaux amorphes ou très cristallisés.
La filière hydrogène est actuellement en plein essor : comment ne pas voir en effet dans ce gaz le vecteur énergétique du futur pouvant offrir une énergie propre et durable ? Seule ombre au tableau : plus de 95% de la production d’hydrogène actuelle fait encore intervenir des ressources fossiles, via un procédé qui émet environ 10 kg de CO2 par kg d’H2 produit. Les électrolyseurs à membranes échangeuses de protons (PEM) sont parmi les technologies les plus prometteuses permettant la conversion d’électricité en hydrogène de façon décarbonée.
Dans un électrolyseur PEM, la réaction la plus complexe est la réaction d‘oxydation de l’eau (ou Oxygen Evolution Reaction, OER), qui a lieu à l’anode à un potentiel élevé et en milieu acide. Ainsi, seuls les électrocatalyseurs à base d’iridium, et plus particulièrement l’oxyde d’iridium IrO2, sont hautement actifs et stables dans ces conditions. Cependant, l’iridium est l’un des éléments les moins abondants sur terre, d’où son prix très élevé et qui ne cesse d’augmenter.
De nombreuses études, utilisant des techniques operando, ont été publiées ces 5 dernières années avec pour objectif de comprendre l’efficacité de l’oxyde d’iridium pour l’OER afin de concevoir de nouveaux catalyseurs avec des teneurs plus faibles en iridium et tout aussi efficaces. Même s’il est bien connu que IrO2 est beaucoup plus actif lorsqu’il est amorphe ou pseudo-amorphe que lorsqu’il est cristallin, ces études n’ont pas permis de trancher sur l’origine de cette différence. Deux hypothèses sont avancées : l’importance de la structure cristallographique locale du catalyseur, ou celle de sa structure électronique et de la présence d’iridium au degré d’oxydation +III au sein du matériau. Pour l’oxyde d’iridium pur (IrO2 ou IrOx), le passage de l’état amorphe à l’état cristallin s’opère autour de 400-450 °C sous air et c’est aussi dans cette même gamme de température qu’a lieu la transition d’un état d’oxydation mixte +III/+IV à un état d’oxydation +IV. Il est donc impossible de décorréler l’influence de ces 2 paramètres sur l’activité électrocatalytique de IrO2 pur et de déterminer lequel est le plus important.
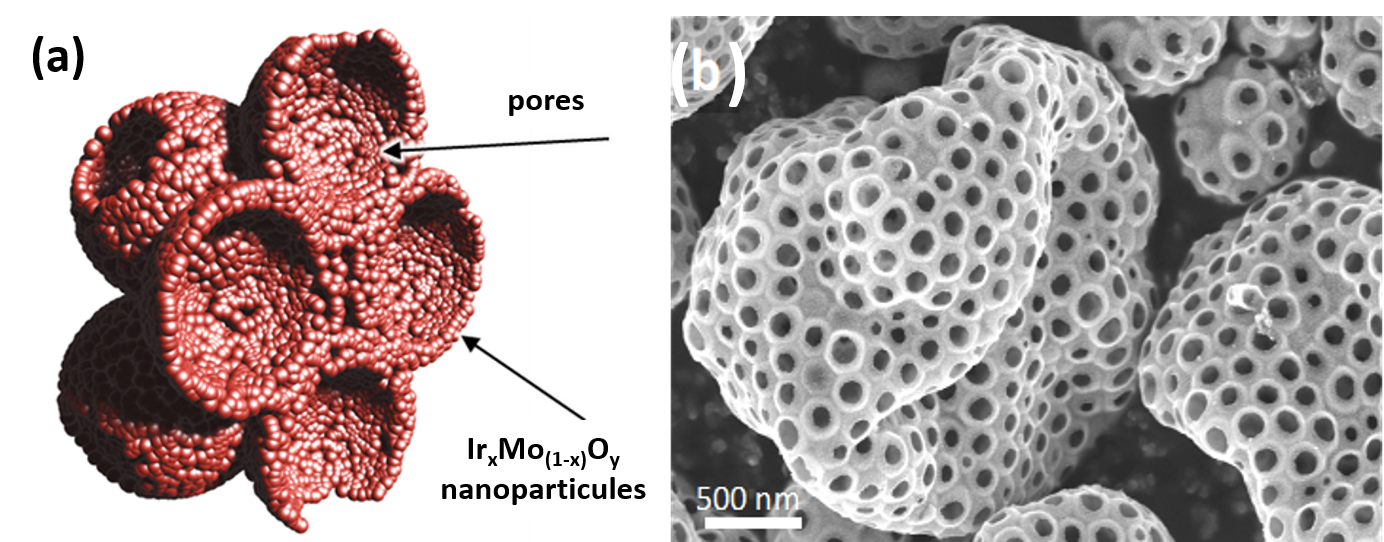
En s’inspirant de leurs travaux précédents réalisés sur IrO2 pur, des chercheurs de l’ITODYS (Université de Paris) et du LCMCP (Sorbonne Université) ont fabriqué une série d’oxydes mixtes IrMOx (avec M = Ti, Co, Mn, Mo), via un procédé aérosol, dans le but d’obtenir des catalyseurs performants tout en diminuant la quantité d’iridium engagée. Ces oxydes mixtes se présentent sous la forme de sphères microniques ultra-poreuses dont les parois sont constituées de nanoparticules (fig. 1).
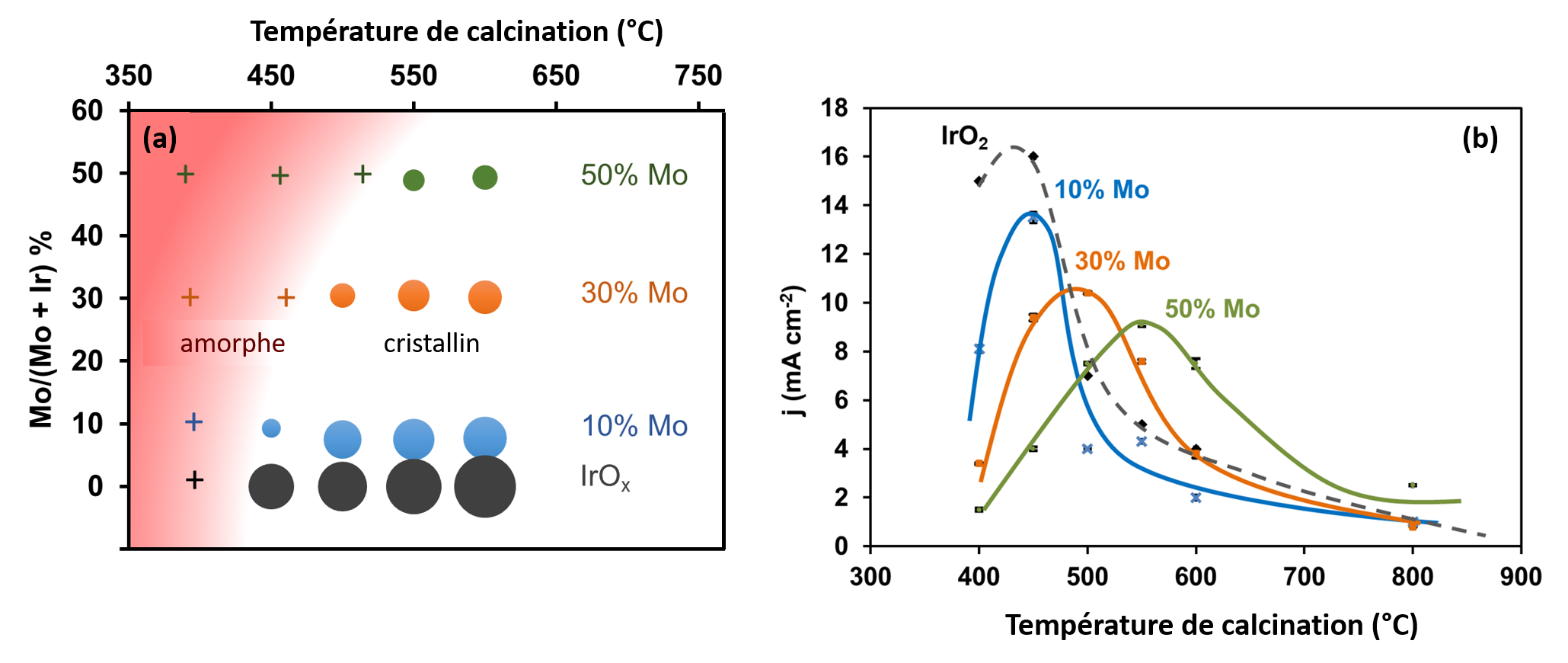
Dans le cas des oxydes mixtes IrMoOx, la présence de Mo induit, de façon surprenante, un retard de la cristallisation, c’est-à-dire que la température de transition cristallin-amorphe augmente avec la teneur en Mo, au-delà de la gamme 400-450°C (fig. 2a). Les caractérisations électrochimiques réalisées en collaboration avec le LCM de l’Ecole polytechnique (fig. 2b) indiquent, de plus, que pour une composition donnée en Mo, le maximum d’activité correspond justement à l’échantillon calciné à cette température de transition.
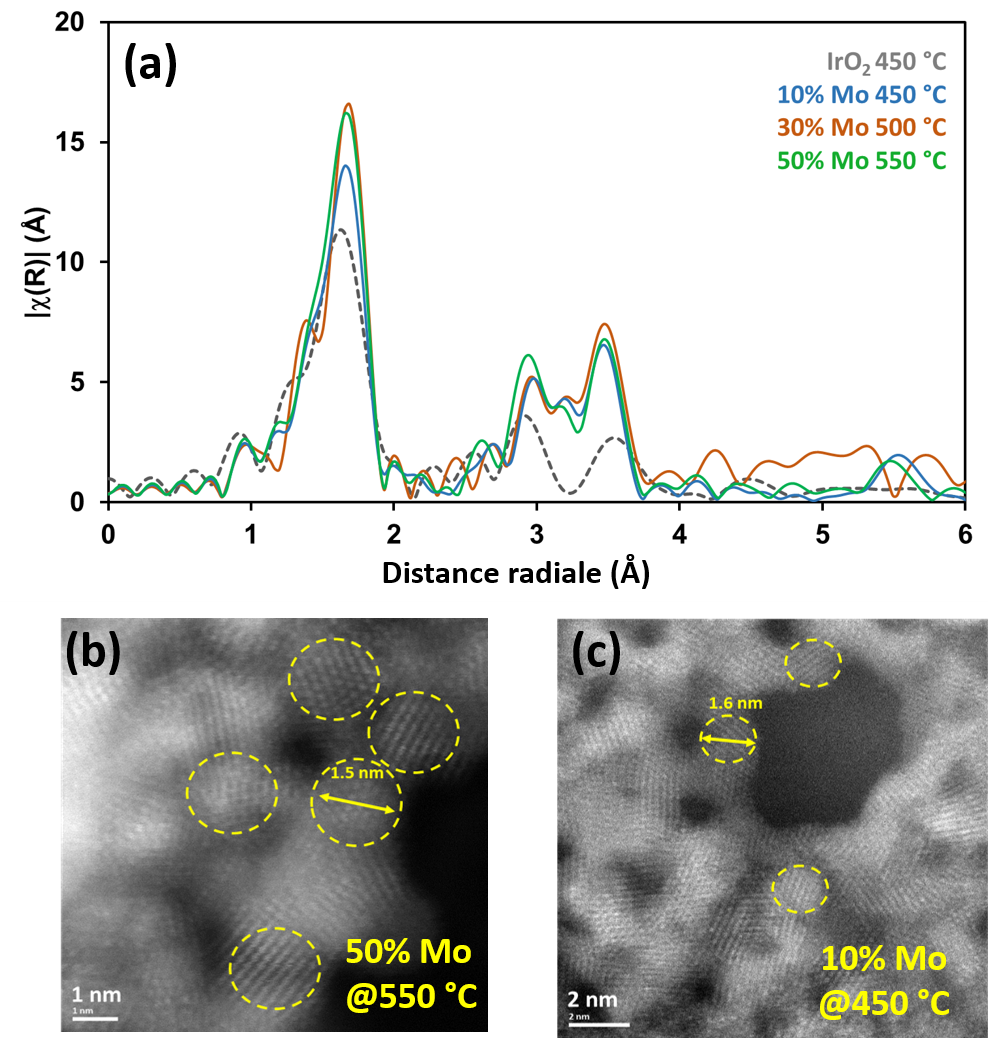
Les analyses des spectres XANES effectuées sur la ligne de lumière SAMBA ex situ et en mode operando ont montré que, quel que soit le pourcentage de Mo, le changement de degré d’oxydation de l’iridium est décorrélé de sa température de transition cristallin-amorphe et se produit systématiquement entre 400 et 450 °C. L’étude des spectres EXAFS ont montré que ce maximum d’activité correspond à un état du matériau obtenu juste après la température de transition, correspondant à un matériau ordonné à courte distance, avec des cristallites de taille inférieure à 2 nm (figure 3).
Cette étude combinant plusieurs approches et techniques contribue au débat sur l’origine de l’activité de IrO2 « pseudo-amorphe » en mettant en évidence l’importance de son état cristallin devant son état d’oxydation. C’est une avancée très importante dans la conception de nouveaux catalyseurs efficaces et stables pour la réaction d’OER dans les électrolyseurs PEM.