Imagerie de la maladie d'Alzheimer grâce à trois lignes de lumière de SOLEIL
La maladie d'Alzheimer - la démence la plus répandue dans le monde - progresse avec le développement dans le cerveau de dépôts de protéines appelés plaques bêta-amyloïdes. Ces plaques peuvent piéger des métaux impliqués dans l'activité du cerveau.
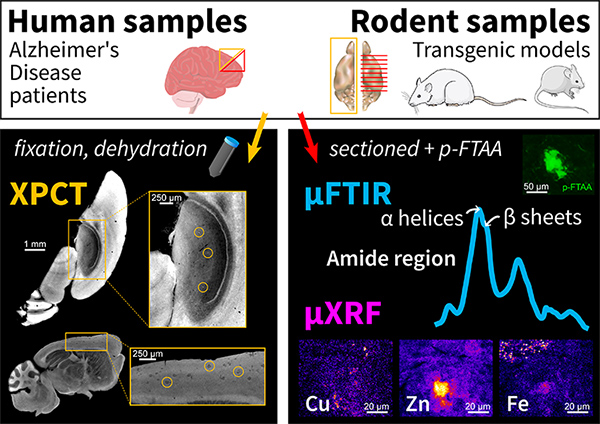
Des chercheurs du Centre de Recherche en Neurosciences de Lyon (CRNL) et de l’unité « Rayonnement Synchrotron pour la Recherche Biomédicale » (STROBE, Grenoble) ont employé une méthode d'imagerie en 3D, la tomographie par contraste de phase (XPCT), pour étudier des échantillons de cerveaux atteints par la maladie. Utilisant les rayons X intenses produits par le synchrotron, la XPCT est une avancée importante par rapport à la microscopie, qui ne fournit que des images en 2D et nécessite que le clinicien découpe les échantillons. Leur nouvelle étude implique 3 lignes de lumière de SOLEIL. Elle révèle que la XPCT permet de détecter les plaques bêta-amyloïdes grâce aux métaux qu'elles emprisonnent.
Alors que la maladie d'Alzheimer touche 10 % des personnes âgées de plus de 65 ans dans le monde, son diagnostic n'est confirmé qu'à l'autopsie du patient : le clinicien sélectionne quelques zones du cerveau qui sont découpées et analysées au microscope. Or, de nouvelles techniques 3D à haute résolution apparaissent pour simplifier le diagnostic au moment du décès. Parmi elles, la tomographie par contraste de phase des rayons X (XPCT) permet de détecter les plaques de bêta-amyloïde, qui sont un marqueur de la maladie. Des chercheurs du Centre de Recherche en Neurosciences de Lyon (CRNL) et du groupe Rayonnement synchrotron pour la recherche biomédicale (STROBE) de Grenoble ont mené une étude afin de comprendre ce qui, dans les plaques, est détecté par cette technique de tomographie.
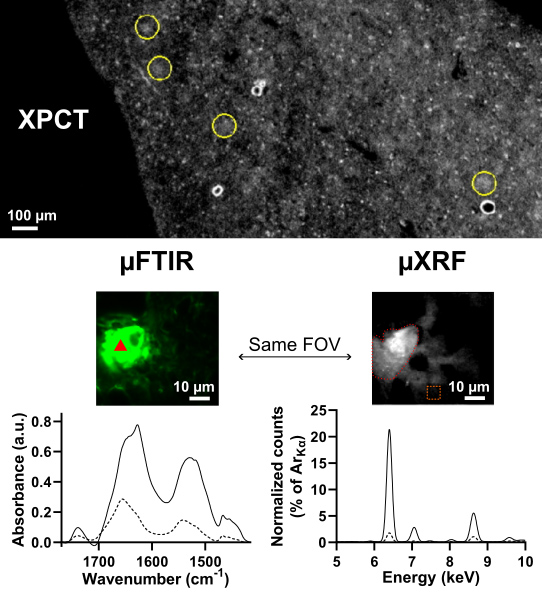
Deux hypothèses ont été avancées : la XPCT détecte 1/ les protéines agrégées (fibrilles) qui composent les plaques, ou bien 2/ les métaux qui sont piégés dans ces plaques. Pour trouver laquelle de ces hypothèses est correcte, des échantillons ont été scannés par XPCT sur la ligne de lumière ANATOMIX puis par deux techniques de spectroscopie, également à SOLEIL : la microspectroscopie infrarouge à transformée de Fourier, µIRTF (ou µFTIR en anglais), sur la ligne SMIS, et la spectroscopie de microfluorescence X, µXRF, sur la ligne NANOSCOPIUM. La µIRTF, qui permet de détecter la signature spécifique des protéines, notamment quand elles sont agrégées en plaques amyloïdes, avait pour but de tester la première hypothèse, tandis que la µXRF, qui donne accès à la composition chimique des échantillons étudiés, a permis de tester la seconde.
La comparaison entre les données de XPCT et celles obtenues avec les deux autres techniques a montré que plus les métaux (en particulier le fer, le cuivre et le zinc) étaient concentrés dans les plaques amyloïdes, plus les plaques apparaissaient brillantes dans les images obtenues par tomographie ; en revanche, la quantité globale de protéines fibrillaires était similaire dans l’ensemble des modèles animaux étudiés et n’expliquait pas à elle seule les distinctions observées en XPCT.
En outre, cette étude a révélé de fortes différences dans l'accumulation des métaux et l'agrégation des protéines, d'une part entre les cas familiaux et non familiaux de la maladie d'Alzheimer : les dépôts d'un cas familial contenaient plus de métaux et plus de fibrilles ; et d’autre part entre les échantillons humains et ceux des modèles animaux de la maladie d'Alzheimer : les dépôts étaient plus grands et les métaux étaient plus dispersés dans les échantillons humains.
Des travaux futurs pourraient utiliser toutes les capacités 3D de la technique XPCT dans le cadre d'une étude de cohorte, afin de comparer cette « histologie virtuelle » aux techniques histologiques standards, qui nécessitent un travail fastidieux de découpe et marquage sur lames de microscope.
|
Film : Rendus 3D du cerveau humain mettant en avant le cortex frontal (données brutes IRM : brain-map.org), et de l'échantillon scanné en XPCT du patient présentant une maladie d'Alzheimer familiale, suivis par le défilement des coupes d'histologie virtuelle du même échantillon où les plaques amyloïdes-bêta ont été annotées. Résolution : 3,09 µm |
Remerciements : les auteurs remercient les scientifiques des lignes de lumière de SOLEIL pour leur accompagnement, ainsi que les patients donneurs et leurs familles.