ANATOMIX

La ligne ANATOMIX (Advanced Nanotomography and Imaging with coherent X rays) fournit des rayons X dans une gamme d'énergie de 5 à plus de 50 keV. Elle est dédiée à la radiographie et la tomographie plein champ, en contraste d'absorption et contraste de phase, et à des tailles de pixel allant de 20 nm jusqu'à 20 µm.
ANATOMIX est une ligne de lumière dédiée à la tomographie aux rayons X, à l'échelle micro- et nanométrique, en contraste d'absorption et contraste de phase. Elle fonctionne dans une gamme d'énergies photoniques comprise entre 5 et 50 keV et permet à ses utilisateurs d'obtenir des images radiographiques en deux et trois dimensions d'échantillons de taille macroscopique, allant jusqu'à plusieurs centimètres d'épaisseur. Pour des échantillons plus petits, la résolution spatiale atteint les 50 nm (correspondant à une taille du pixel de 20 nm). Des études en temps réel sont possibles, à des vitesses d'acquisition de données qui vont actuellement jusqu'à un scan tomographique par seconde. Des vitesses plus élevées d'acquisition sont en cours de développement, ainsi nous avons déjà pu effectuer des séries d'acquisitions à 20 volumes par seconde (50 ms par scan).
Un environnement conçu pour être aussi flexible que possible permet des études in situ et/ou in operando, dans des conditions proches des environnements naturels ou techniques des échantillons (en termes de température, humidité, charge mécanique, fluidique). Les échantillons biologiques peuvent être mesurés en état hydraté. Avec une préparation adaptée des échantillons, l'imagerie cellulaire sans environnement cryogénique est possible.
Tout comme les autres lignes de lumière de SOLEIL, ANATOMIX accueille des utilisateurs venant du monde entier ; l'accès est gratuit pour ceux qui s'engagent à publier leurs résultats et dont les projets sont sélectionnés par un comité de programme (2 appels par an). Si vous envisagez conduire un projet sur ANATOMIX, ne manquez pas de consulter le Guide utilisateur de la ligne ANATOMIX (en anglais, format PDF) et de nous contacter (section "Contacts" ci-dessous) afin de discuter la faisabilité de votre projet avant son dépôt.
| ANATOMIX est un Équipement d'Excellence (EQUIPEX) financé par le programme Investissements d'Avenir (PIA) de l'Agence nationale de la recherche (ANR), projet NanoimagesX, contrat no. ANR-11-EQPX-0031. |
Techniques accessibles à ANATOMIX
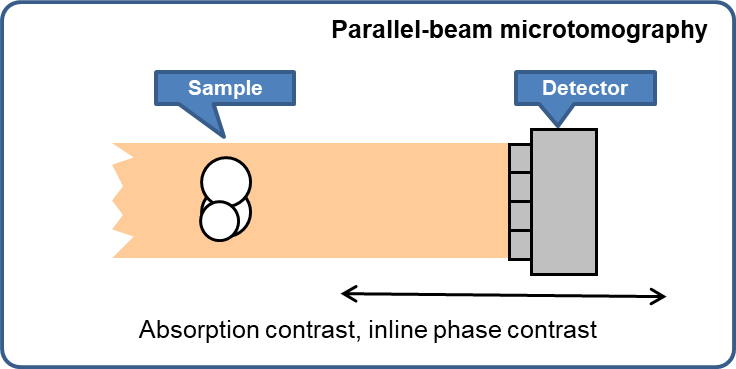
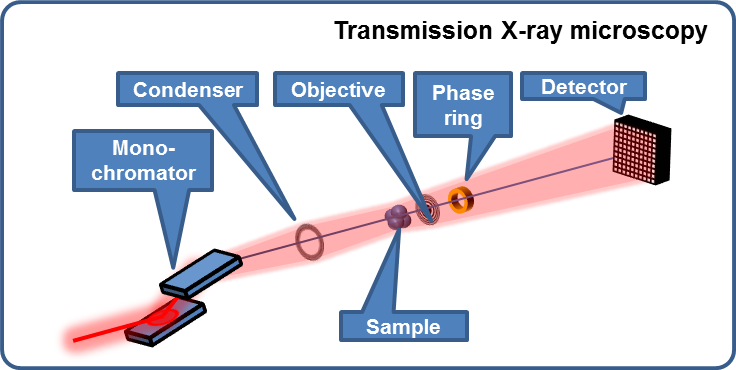
Afin de couvrir les gammes de paramètres décrits ci-dessus, deux types de méthodes radiographiques seront disponibles : la microimagerie à faisceau parallèle et la microscopie RX plein champ en transmission.
Publications récentes issues de travaux effectués sur ANATOMIX :
|
Contacts
Pour plus de détails sur les possibilités techniques et scientifiques sur ANATOMIX, adressez-vous aux permanents de la ligne :
| Timm Weitkamp Scientifique, responsable de ligne |
+33 (0)1 69 35 81 37 timm.weitkamp@synchrotron-soleil.fr |
| Mario Scheel Scientifique, chef de projet nanotomographie (TXM) |
+33 (0)1 69 35 96 31 mario.scheel@synchrotron-soleil.fr |
| Jonathan Perrin Scientifique |
+33 (0)1 69 35 94 99 jonathan.perrin@synchrotron-soleil.fr |
| Guillaume Daniel Assistant-ingénieur |
+33 (0)1 69 35 96 66 guillaume.daniel@synchrotron-soleil.fr |
| Hubert Chevreau Ingénieur matériaux pour les applications industrielles |
+33 (0)1 69 35 97 00 hubert.chevreau@synchrotron-soleil.fr |
| Alessia Melelli Chercheuse postdoctorale |
+33 (0)1 69 35 96 59 alessia.melelli@synchrotron-soleil.fr |
| Shyam Pulickan Chercheur postdoctoral |
+33 (0)1 69 35 94 96 shyam.pulickan@synchrotron-soleil.fr |
Numéros de téléphone des salles de la ligne
| Salle de contrôle Zone optiques | +33 (0)1 69 35 97 31 |
| Salle de contrôle Expériences | |
| Cabane expériences EH3 | +33 (0)1 69 35 97 82 |
| Cabane expériences EH4 | |
| Salle de réunion et d'analyse de données | +33 (0)1 69 35 97 71 |
| Salle de préparation | |
| Atelier | +33 (0)1 69 35 99 80 |
L'équipe


* Prestataire extérieur, intérimaire ou collaborateur
Les actualités de la ligne
Toutes les actualités de la ligne
Highlights de SOLEIL 2024

Qu’a apporté SOLEIL à la transition énergétique ?
Offres d'emploi & de stage
Accéder aux offres d'emploi de SOLEIL
Données techniques
- Techniques expérimentales
-
Microtomographie à faisceau parallèle
- Contraste d'absorption
- Contraste de phase par propagation
Nanotomographie via microscopie X plein champ à lentilles Fresnel
- Contraste d'absorption
- Contraste de phase Zernike
- Domaine d’énergie
-
Microtomographie
- Entre 5 et 50 keV
- Jusqu'à environ 25 keV en faisceau monochromatique
Nanotomographie
- de 5 à 11 keV ; 17 keV
- Taille du faisceau sur l’échantillon
-
Microtomographie
- sans miroir M1-M2 : jusqu'à 20 mm (H) × 15 mm (V)
- avec miroir M1-M2 : jusqu'à 40 mm (H) × 15 mm (V)
Nanotomographie
- environ 0.04 mm × 0.04 mm
- Modes de faisceau/ Résolution en énergie
-
Microtomographie
- Faisceau blanc filtré
- Monochromateur double cristal Si-111 (ΔE/E = 10-4)
- Monochromateur double multicouche (ΔE/E = 10-2) – prévu
Nanotomographie
- Monochromateur double cristal Si-111 (ΔE/E = 10-4)
- Source
-
Onduleur cryogénique sous vide U18
- Optiques
-
Ouverture d'entrée : diaphragme 2.5 mm × 2.0 mm (H×V), à 22.7 m de la source.
Fente horizontale de cohérence, à 23.2 de la source.
Fentes primaires, à 26 m de la source.
Double miroir (escamotable), à déflection et focalisation horizontales, f=3.5 m, à 35.5 m de la source.
Lentilles refractives pour collimation, à 38 m de la source (prévues).
Fente horizontale de source secondaire (utilisée avec le miroir), à 39 m de la source.
Monochromateur à double cristal (Si-111), escamotable, deflection verticale, à 50 m de la source.
Monochromateur à double multicouche, escamotable, deflection verticale, à 53 m de la source (prévu).
- Détecteurs
-
Tous nos détecteurs sont basés sur le principe de la détection indirecte couplée par lentilles : l'image RX est convertie en image visible par un écran fluorescent (scintillateur). L'image visible est ensuite projetée sur un capteur numérique à pixels par une optique à lentilles. En microtomographie, la taille effective du pixel est égale à la taille du pixel sur le capteur, divisée par le grossissement. Par exemple, l'utilisation d'une optique à grossissement 10 avec une caméra dont la taille de pixel est de 6.5 µm donnera une taille effective de pixel de 0.65 µm. (En nanotomographie par TXM, cette valeur doit être encore divisée par le grossissement d'image au niveau des rayons X dans le microscope RX, afin d'obtenir la taille de pixel effective au niveau de l'échantillon.)
Optiques détecteurs :
Grossissements disponibles : ×0.48, ×1, ×2.1, ×5, ×7.5, ×10, ×20, ×50 Sensors:
Modèle Orca Flash 4.0 V2 Orca Lightning Dhyana95 V2 Dimax HS4 Fabricant Hamamatsu Hamamatsu Tucsen PCO Type CMOS CMOS CMOS CMOS Nb pixels 2048×2048 4608×2592(a) 2048×2048 2000×2000 Taille pixel 6.5 µm 5.5 µm 11.0 µm 11.0 µm Cadence maxi(b) 20 fps(c) 30 fps 24 fps 2277 fps Temps d'exposition 40 µs to 10 s 50.4 µs to 1 s 21 µs to 10 s 1 µs to 40 ms Mémoire pour données ≈1 TB(d) ≈1 TB(d) ≈1 TB(d) 36 GB(d) ADC 16 bit 16 bit 16 bit 12 bit SNR max 37000 17000 31600 1600 QE max 82 % 60 % 95 % 47 % (a)Camera is always mounted in landscape orientation. We recommend limiting the ROI to no more than 3000×2400 pixels to avoid distortion effects. (b)For a full, unbinned frame. (c)Supplier specifies up to 100 fps but we encounter stability issues above 20 fps. (d)Limited by hard-disk size of camera PC. (e)Limited by camera on-board memory.
Thématiques scientifiques
| Information accessible |
|
|---|---|
| Etudes fonctionnelles |
|
| Domaines d'application |
|
| Exemples: Microimagerie à faisceau parallèle | |
|---|---|
|
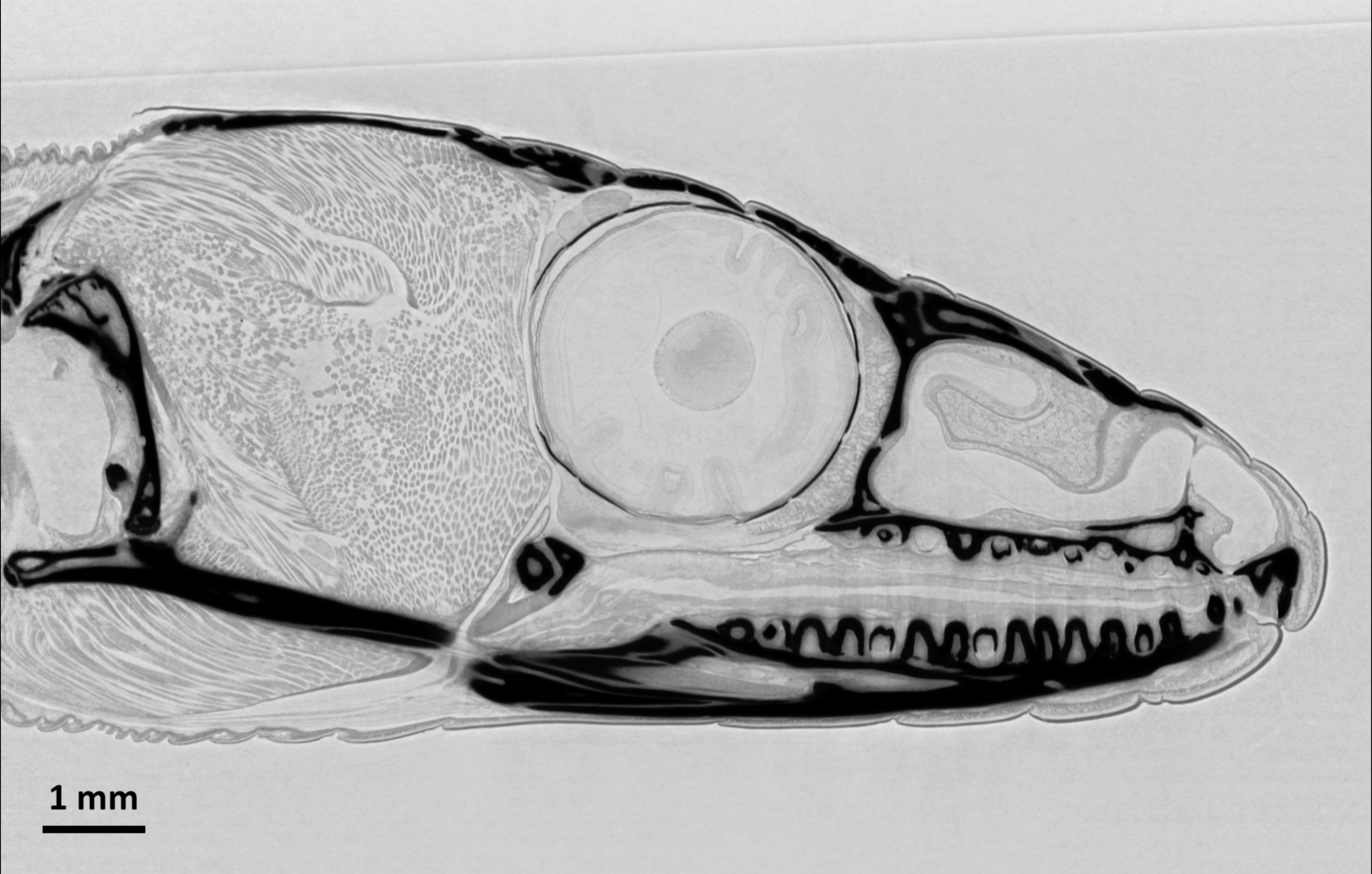
Microtomographie en contraste de phase d’un objet large : coupe virtuelle tomographique à travers la tête d’un lézard des murailles (Podarcis muralis). On note les détails de tissus mous, visibles par contraste de phase. L’animal mort a été immergé dans de l’éthanol pour les mesures. Données acquises sur ANATOMIX avec un détecteur indirect (scintillateur LuAG, objectif photo 1× et caméra sCMOS) avec une taille effective du pixel de 6,5 µm, résultant en une résolution spatiale autour de 15 µm. Les données volumiques ont été acquises en 7 minutes avec un faisceau RX blanc filtré d’une énergie photonique centrale d’environ 25 keV et à une distance échantillon–détecteur de 1,2 m. |
|
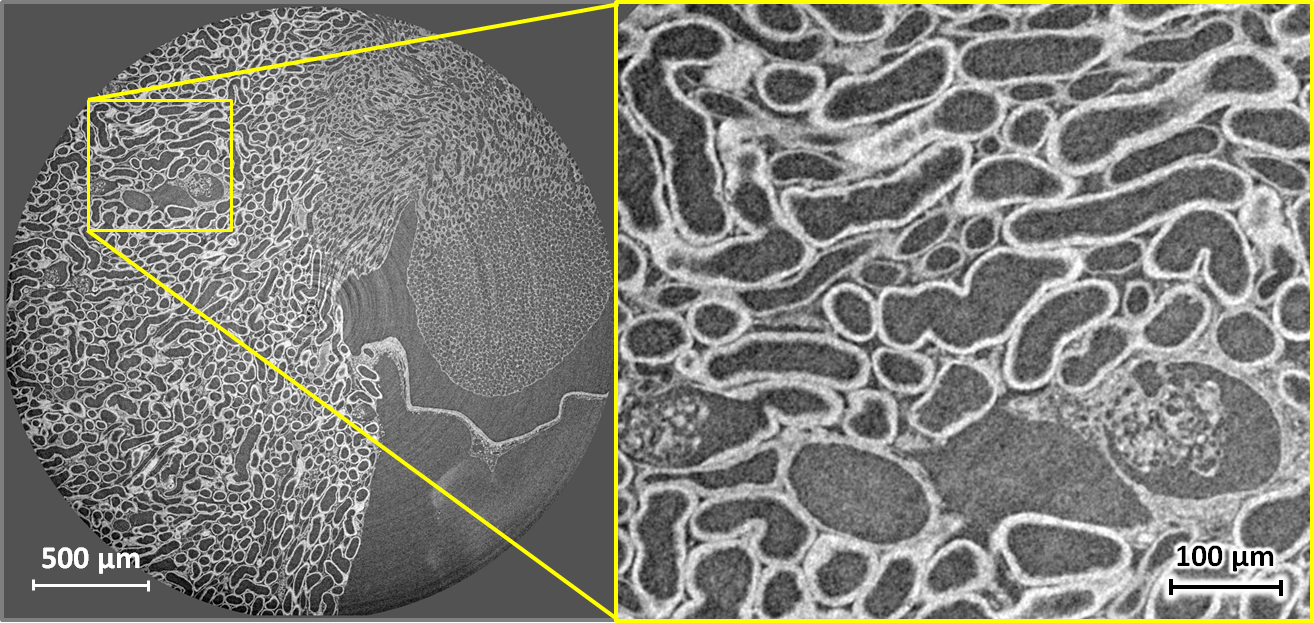
Microtomographie de tissus mous biologiques : coupe tomographique horizontale en contraste de phase à travers le rein d’une souris. Le temps d’acquisition pour le volume a été de 5 minutes à une énergie photonique de 17 keV et une distance échantillon–détecteur de 33 mm ; taille effective du pixel : 1,3 µm, résolution spatiale environ 2,5 µm. Un filtre type Paganin a été appliqué dans la reconstruction. L’échantillon a été préparé avec une solution d’iode 90 mg/ml dans de l’agar. A gauche, coupe complète. A droite, détail agrandi. Echantillon fourni par Georg Schulz, Biomaterials Science Center, Université de Bâle (Suisse). |
|
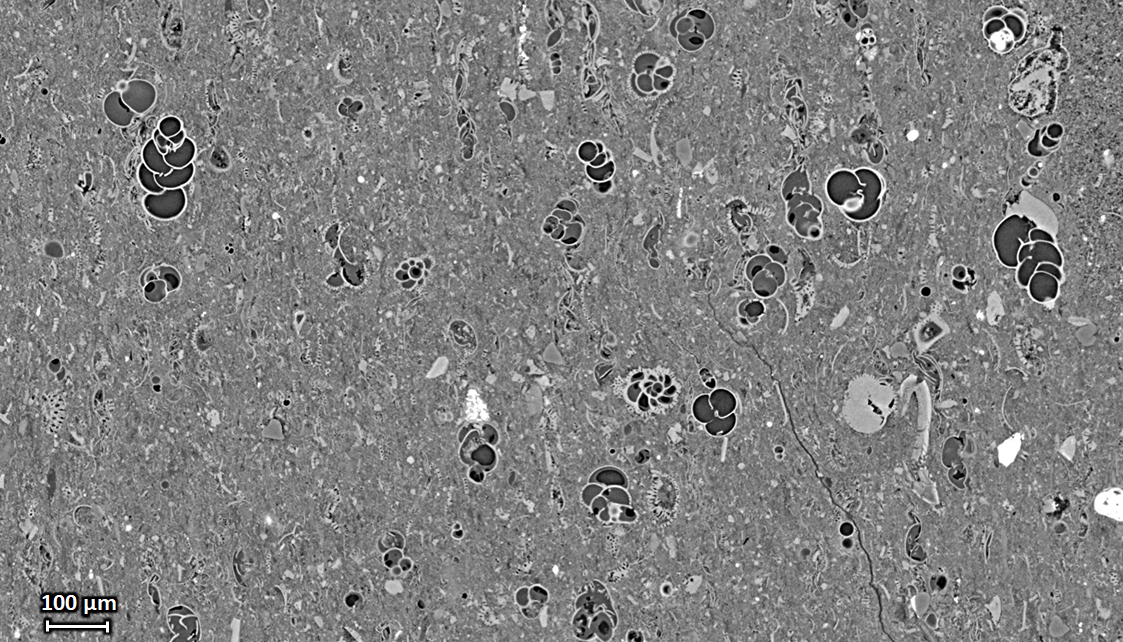
Microtomographie à champ étendu. Coupe tomographique verticale à travers un morceau de roche shale avec des inclusions de foraminifères, acquis à une taille du pixel de 0,65 µm. La taille du volume imagé a été augmenté en positionnant l’axe de rotation proche d’un bord du champ du détecteur, plutôt qu’au centre de celui-ci (« demi-acquisition »). Echantillon fourni par Roland Pellenq, MSE², Massachusetts Institute of Technology / CNRS / Aix-Marseille Université, Cambridge, Massachusetts, USA. |
| Exemples: Microscopie RX plein champ en transmission | |

|
Nanotomographie (coupe verticale) d’une pâte de ciment à 10 keV. Le TXM a été utilisé en contraste de phase Zernike, avec une taille de pixel de 21 nm. La résolution est estimée à 85 nm (H) × 75 nm (V). L’échantillon a été découpé par FIB-SEM (usinage par faisceau d’ions focalisé combiné à un microscope électronique à balayage). Echantillon fourni par Roland Pellenq, MSE², Massachusetts Institute of Technology / CNRS / Aix-Marseille Université, Cambridge, Massachusetts, Etats-Unis. |
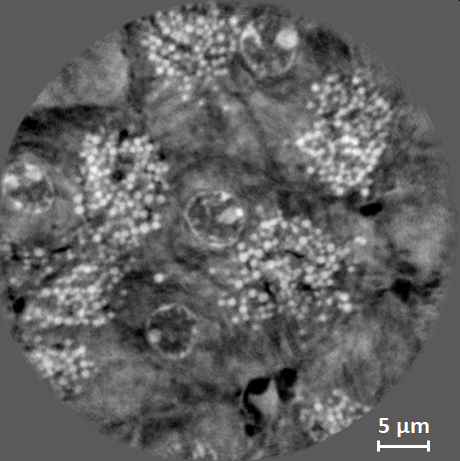
|
Nanotomographie locale de tissu mou biologique, ici : un pancréas murin à 10 keV. L’image montre une coupe axiale à travers le volume reconstruit. Le TXM a été utilisé en contraste de phase type Zernike, à une taille de pixel de 44 nm. La résolution spatiale de l’image est estimée à 200 nm. Le pancréas a été extrait, fixé en formaline, déshydraté et enrobé dans de la paraffine. L’échantillon a été coupé en forme de bâtonnet d’un diamètre de 1,5 mm ; un volume de 40 µm de diamètre et de hauteur a été imagé en tomographie locale. Echantillon fourni par Raphael Scharfmann, INSERM / Institut Cochin, Paris. |