Des photoélectrons de haute énergie pour étudier les phénomènes redox dans les batteries au lithium
On attend des batteries au lithium qu’elles soient toujours plus performantes, en particulier pour les applications gourmandes en énergie comme les véhicules électriques ou le stockage des énergies renouvelables. Une des pistes de recherche est la mise au point de nouveaux matériaux d'électrode positive à plus forte capacité massique, c’est-à-dire capables d'échanger un plus grand nombre d'ions lithium pour un même poids de matériau. Pour ces matériaux, la présence d'un métal de transition est nécessaire pour atteindre les hauts potentiels électrochimiques requis. Mais cela se fait au détriment de la capacité massique car ces éléments ont une masse molaire plus élevée que des éléments légers comme le carbone ou l'oxygène.
Une solution envisagée consiste à utiliser des matériaux capables d'échanger plus d'ions Li+ grâce à des réactions d'oxydo-réduction (redox) impliquant non seulement le cation (le métal) comme dans les matériaux "classiques", mais également l'anion. Ces matériaux dits "lithium-rich" de formule générale Li1+xM1-yO2 (où M est un métal de transition ou un mélange de différents métaux) posent cependant de nombreux problèmes : les phénomènes redox impliquant l'oxygène sont accompagnés de réarrangements structuraux irréversibles, voire des dégagements de O2 gazeux, avec pour conséquence de mauvaises propriétés électrochimiques : pertes de capacité massique au cours des cycles de charge/décharge, cinétique lente et chute de potentiel.
Ces problèmes sont dus à un mauvais positionnement des niveaux électroniques nd du métal (3d pour les métaux usuels) par rapport aux niveaux np de l'anion (2p pour l'oxygène). Des chercheurs du laboratoire de Chimie du Solide et Energie (UMR 8260) du Collège de France ont eu l'idée de travailler sur des anions de la même famille que l'oxygène (les chalcogènes) mais situés plus bas dans la classification périodique (S et Se), ce qui fait coïncider beaucoup mieux les niveaux 3p ou 4p de l'anion avec les niveaux 3d du métal. Grâce à une collaboration avec l'Université de Pau et des Pays de l'Adour (IPREM, E2S-UPPA) et la ligne de lumière GALAXIES, ils ont mis en évidence par la technique HAXPES (Hard X-ray Photoemission Spectroscopy) les phénomènes redox complexes impliquant le métal et les anions S2- et Se2- dans le matériau Li2TiS2.4Se0.6, en analysant les photoélectrons émis lors de l'irradiation d'électrodes par des photons de très haute énergie (10 keV).
L'utilisation de photons de 10 keV sur la ligne GALAXIES pour analyser ces matériaux, par rapport à des énergies de photons standard (1487 eV), présente un triple avantage :
- multiplier par 4 le rapport d'intensité entre les signaux Se 3p et S 2p, ce qui permet de rendre prédominant le signal Se 3p du sélénium, qui sans cela est difficile à interpréter car il est superposé avec le signal S 2p du soufre,
- accéder au signal S 1s du soufre (signal de haute énergie), qui ne présente aucune superposition avec un signal du sélénium et permet donc une interprétation aisée des phénomènes redox du soufre,
- augmenter considérablement la profondeur d'analyse de la photoémission (> 40 nm) afin de s'affranchir des signaux parasites provenant de la surface du matériau, toujours présents car dans une batterie l'électrode est toujours en contact avec un électrolyte qui présente une certaine réactivité interfaciale avec l'électrode.
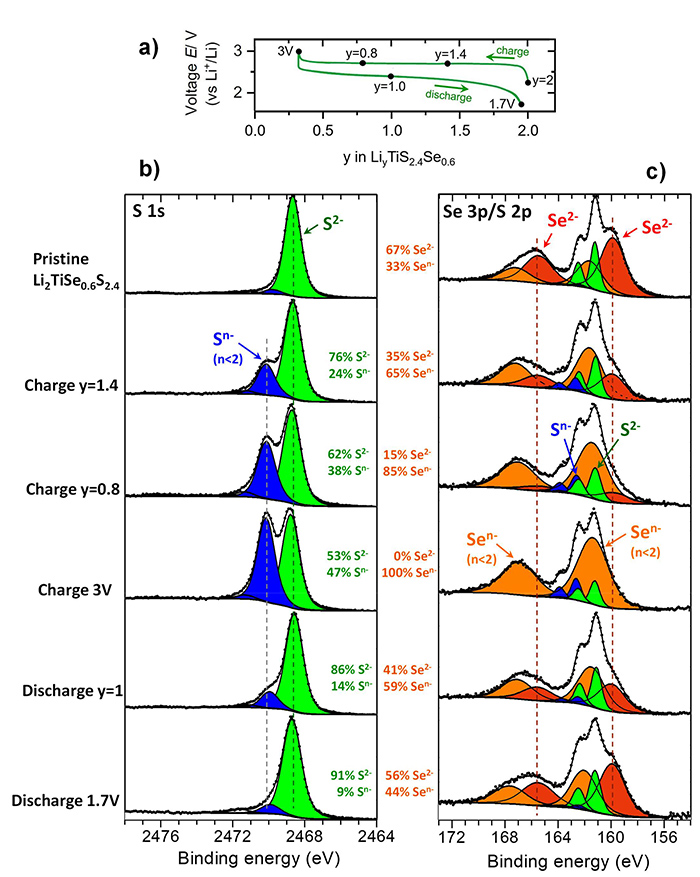
La figure 1a montre la charge/décharge électrochimique et la montée/descente en potentiel lorsque le lithium est extrait/réinséré dans le matériau. Les différents stades d'extraction/réinsertion indiqués sur la figure sont ceux qui ont été analysés par HAXPES (figure 1b, 1c) afin de révéler les processus redox impliquant le soufre et le sélénium. Bien que ces deux éléments soient tous les deux oxydés lors de la charge (passage d'une charge négative 2- à une charge négative inférieure n-, avec n<2) ils ont des comportements différents, avec une oxydation plus précoce et plus profonde du sélénium par rapport au soufre. Ce découplage entre les comportements redox de S et Se permet de mieux expliquer pourquoi le comportement électrochimique d'un matériau associant ces deux éléments est bien meilleur que celui d'un matériau à base de soufre seul (Li2TiS3) ou de sélénium seul (Li2TiSe3).
a) Courbe de charge/décharge de Li2TiS2.4Se0.6 ;
b,c) Spectres HAXPES S 1s, 2p et Se 3p à 10 keV montrant l'oxydation / réduction progressive des anions au cours de la charge / décharge. Se s'oxyde plus tôt et plus profondément que S.
Cette étude montre ainsi que deux activités anioniques indépendantes peuvent coexister au sein d'un même matériau d'électrode, ce qui offre des opportunités pour optimiser le positionnement des niveaux d'énergie np des ligands par rapport aux niveaux d'énergie nd du métal pour améliorer les performances électrochimiques des chalcogénures de métaux de transition en tant que matériaux d'électrodes pour batteries au lithium.