Coqueluche : La pêche à la calmoduline avec un appât désordonné active la toxine CyaA
La protéine CyaA est une toxine produite par la bactérie responsable de la coqueluche. Lors de l’intoxication des cellules cibles, CyaA se lie à la calmoduline, ce qui induit le repliement d’une région déstructurée de la toxine et son activation. Ce mécanisme est essentiel pour permettre l’activation de la toxine quand elle atteint ses cellules cibles - qui contiennent la calmoduline – tout en prévenant sa toxicité au sein des bactéries qui la produisent - et ne contiennent pas de calmoduline. Ces travaux, menés par des équipes de l’Institut Pasteur et de l’I2BC, ont nécessité l’emploi de différentes techniques biophysiques, dont la diffusion des rayons X aux petits angles (SAXS) sur la ligne de lumière SWING et le dichroïsme circulaire sur la ligne DISCO.
La calmoduline est une protéine eucaryote très conservée qui interagit avec une grande variété de protéines et d'enzymes. Elle contrôle leurs activités en réponse aux variations de concentrations en calcium intracellulaire. La toxine adénylate cyclase (CyaA) est un des facteurs de virulence majeur de Bordetella pertussis, la bactérie responsable de la coqueluche. CyaA contribue aux étapes précoces de colonisation bactérienne des poumons des personnes infectées. La toxine CyaA est synthétisée et sécrétée par la bactérie B. pertussis sous une forme inactive. Après invasion des cellules eucaryotes cibles, le domaine catalytique de CyaA est activé par la calmoduline pour synthétiser alors de grandes quantités d'AMPc qui altèrent la physiologie de la cellule cible. L’activation de CyaA par la calmoduline est connue depuis longtemps mais le mécanisme d’activation moléculaire restait une énigme.
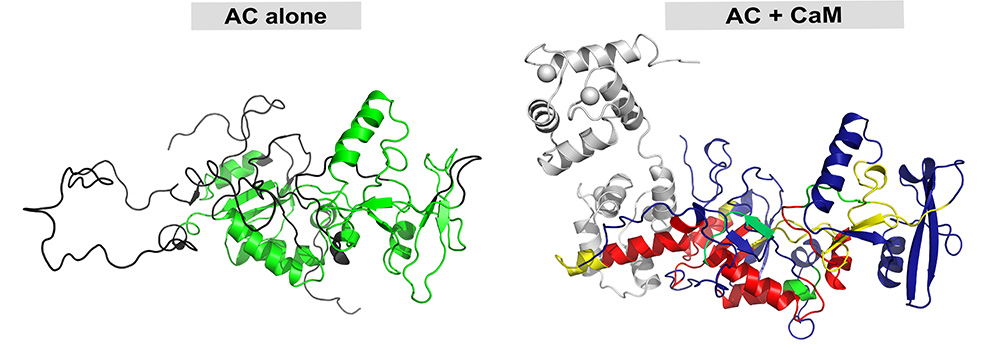
Les chercheurs ont utilisé une approche de biologie structurale intégrative combinant plusieurs techniques biophysiques pour caractériser les changements de structure du domaine catalytique de CyaA et de la calmoduline lors de leur interaction. En couplant la diffusion des rayons X aux petits angles (SAXS), les échanges hydrogène deuterium suivis par spectrométrie de masse (HDX-MS) et le dichroïsme circulaire avec rayonnement synchrotron (SR-CD), cette étude a permis d’élucider la relation entre structure et activation de CyaA.
Il est apparu qu’une région désordonnée de 75 acides aminés dans le domaine catalytique de CyaA sert d'appât pour la capture de la calmoduline. La liaison induit un repliement important dans cette région, prérequis pour l'activation de CyaA. Au-delà de la région d’interaction entre la calmoduline et le domaine catalytique, la formation du complexe induit des modifications allostériques et stabilise le site catalytique distant de la zone d’interaction. Une boucle catalytique cependant est maintenue dans un état très flexible, ce qui est essentiel pour une catalyse enzymatique efficace en permettant une association/dissociation rapides des substrats (ATP) et produits (AMPc et pyrophosphate). Cette réduction du désordre structural pourrait être pertinente pour d'autres enzymes activées par la calmoduline.