Comment contrôler dynamiquement le diamètre de nanotubes biomimétiques ?
Des chercheurs français ont montré qu’il est possible de générer par auto-assemblage des nanotubes dont le diamètre est contrôlé dynamiquement par l’acidité du milieu. Pour cela, ils ont utilisé une «brique de base» qui existe sous deux formes différentes en fonction du pH. Ces deux formes s’assemblent spontanément pour construire deux nanotubes distincts de 10 ou 50 nm de diamètre.
La Nature excelle dans l’art de former des architectures complexes à l’échelle nanométrique. Pour cela, elle utilise l’assemblage spontané de « briques de base », similaire à des Lego™, qui contiennent toute l’information nécessaire à l’établissement de leurs futurs contacts au sein de la structure programmée.
Ce procédé simple qui permet de fabriquer sans effort, en grand nombre, et avec une précision inégalée des nanoobjets est une source d’inspiration pour les chercheurs. Il est ainsi aujourd’hui possible de concevoir des objets de toutes formes et avec des fonctions de base variées. Ces architectures sont toutefois statiques et il est impossible de changer, voire de contrôler leur morphologie par un stimulus externe.
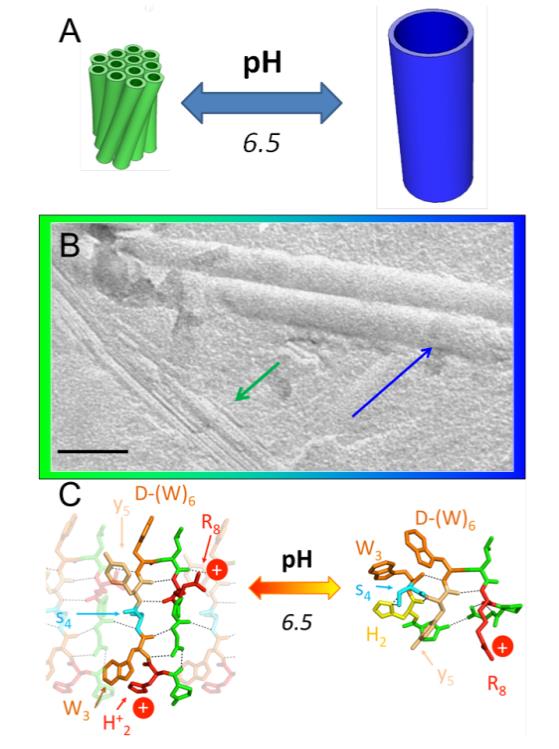
Dans ce contexte, les chercheurs ont découvert une molécule qui s’assemble dans l’eau sous forme de nanotubes dont le diamètre peut être guidé à volonté vers 11 ou 50 nm par le pH.
Les scientifiques du CNRS, du CEA-iBiTec-S, de l’université Rennes 1 et d'Ipsen se sont intéressés à une petite molécule, la triptoréline. Il s’agit d’un peptide formé de 10 acides aminés, qui est un analogue d’une hormone naturelle, la Gonadoréline. Lorsque la poudre de ce médicament est mise dans l’eau, un gel blanchâtre apparait au bout de quelques heures. De manière surprenante la texture de ce gel se modifie en moins d’une journée en fonction de l’acidité du milieu. Il est possible de passer plusieurs fois d’une texture à l’autre.
En cherchant à comprendre l’origine de ce changement, avec l’aide des lignes SWING et PROXIMA1 de SOLEIL, les chercheurs ont très vite soupçonné l’existence de nanotubes présentant des diamètres variables. La confirmation est venue d’une technique permettant de visualiser les objets à l’échelle nanométrique, la microscopie électronique (figure 1). La compréhension du mécanisme nécessitait de connaître précisément l’organisation de la triptoreline dans les nanotubes de diamètres différents. Les détails atomiques n’ont pu être obtenus que grâce à l’utilisation de plusieurs techniques expérimentales donnant chacune un point de vue complémentaire à différentes échelles : spectroscopies vibrationnelles, diffusion et diffraction des rayons X, disponibles à SOLEIL.
La clef de ce mécanisme repose sur un acide aminé particulier de la triptoréline, une histidine, qui peut fixer, ou non, des protons en fonction du pH. En milieu acide cette histidine, en liant un hydrogène de l’eau, est chargée positivement. Les répulsions électrostatiques qui en résultent imposent alors une conformation très particulière au peptide. En diminuant l’acidité il y a perte de cet hydrogène et l’histidine devient neutre, mais garde son affinité pour les protons et remplace celui de l’eau par un hydrogène d’un autre acide aminé du peptide. Cela a pour effet de bouleverser sa conformation. Les caractéristiques géométriques des auto-assemblages dépendent bien évidemment de la conformation initiale du peptide qui, dans ce cas, est lié à l’acidité du milieu. Les nanotubes s’adaptent dynamiquement au changement d’acidité par modification de leur diamètre, passant de 11 à 50 nm.
La compréhension détaillée de ce mécanisme ouvre de nombreuses perspectives. En effet, le fait qu’un tel caractère « pH responsive » existe chez un peptide de sept acides aminés (3 des acides aminés de la triptotéine ne sont pas impliqués) permet d’envisager de l’insérer facilement dans de nombreux autres systèmes appliqués, tant dans le domaine des nanomatériaux que de la pharmacie.
De plus, les détails atomiques du mécanisme élucidés par les chercheurs apportent un éclairage nouveau sur les changements de conformations des virus qui profitent également de variations de pH.