Batteries au lithium
Toute amélioration des performances des batteries passe par une meilleure compréhension du fonctionnement général de ces différents éléments: électrodes, électrolytes et interfaces. Sont présentées ici deux études portant sur un matériau d’électrode positive et sur un matériau d’électrode négative à partir de mesures effectuées en operando sur plusieurs lignes de lumière de SOLEIL.
Depuis ces vingt dernières années la demande de capacité de stockage de l'énergie n’a cessé de croître. Qu’il s’agisse de faire avancer une voiture électrique, de faire fonctionner un portable (téléphone ou ordinateur), ou encore d’utiliser des cellules photovoltaïques ou une éolienne, il est toujours question de production, consommation et stockage d’énergie, avec pour élément central : les batteries.
La recherche mondiale est très active dans ce domaine avec comme objectif principal les batteries permettant de stocker une densité d’énergie maximale à faible coût et présentant des conditions de sécurité optimales.
Toute amélioration des performances des batteries passe par une meilleure compréhension du fonctionnement général de ces différents éléments: électrodes, électrolytes et interfaces. Concernant les batteries au lithium, deux approches sont couramment concevables : l’étude de matériaux pour l’électrode positive ou pour la négative. La spectroscopie d’absorption des rayons X est une technique de caractérisation particulièrement bien adaptée pour explorer les mécanismes électrochimiques mis en jeu dans les électrodes de la batterie, au travers des mesures operando (une cellule spécifique pour les mesures in-situ a été mise au point récemment [1]). Sont présentées ici deux études récentes sur un matériau d’électrode positive et sur un matériau d’électrode négative à partir de mesures effectuées en operando sur plusieurs lignes de lumière de SOLEIL.
Que se passe-t-il dans une batterie en fonctionnement ?...
Des études récentes ont clairement démontré le rôle majeur joué par la formulation et la synthèse des électrodes dans les performances de la batterie. Les électrodes sont des matériaux composites, c’est-à-dire formées d’un mélange de matériau actif (vis-à-vis du Li), d’un agent conducteur (carboné) et d’un liant. Les paramètres principaux de la formulation d’électrodes sont la taille des particules, la proportion de matière active par rapport aux additifs conducteurs et liants polymères, ces derniers assurant la porosité et la tenue mécanique de l’électrode.
La percolation électronique et simultanément la diffusion ionique des ions dans l’électrode sont les facteurs clefs du bon fonctionnement de la batterie.
Idéalement ces deux espèces chargées (électrons et ions lithium) doivent entrer et sortir des particules dans les mêmes quantités et à la même vitesse. Si ce n'est pas le cas, la transformation de la particule correspondante sera probablement retardée par rapport à l’état de charge moyen déterminé par mesure électrochimique de toute l'électrode. Pour compenser ce retard, les particules bien « connectées » auront un état de transformation (lithiation ou délithiation) plus avancé. Un tel comportement peut induire, au moins avant la mise à l’équilibre, d’importantes hétérogénéités dans l'électrode. Cette question a été abordée par certains groupes de recherche, soit en utilisant des méthodes spectroscopiques au repos ou par des considérations thermodynamiques. Ainsi, une importante question encore en suspens est donc : « Quel est le degré d'homogénéité d'une électrode au cours de son fonctionnement dans son contenu en lithium et en électrons ? »
Techniques et approches
Afin de répondre à cette question, il est important de pouvoir étudier les batteries à plusieurs échelles de temps et d’espace. Rappelons aussi que ces matériaux d’électrodes sont des centres d’oxydation et de réduction qui acceptent, au cours du fonctionnement de la batterie, des quantités variables d’électrons et d’ions lithium. De ce fait, ils sont continûment l’objet de changements structuraux et électroniques. La diffraction des rayons X (DRX) et la spectroscopie d’absorption des rayons X (XAS) ont été employées car il s’agit de techniques éprouvées pour leur efficacité dans la caractérisation de la structure atomique et électronique de la matière. En raison du flux de photons très élevé délivré par les sources de rayonnement synchrotron et le développement technique récent de nouvelles lignes de lumière, plusieurs montages expérimentaux ont été utilisés (sur les lignes SAMBA, ODE, LUCIA et CRISTAL) afin de combiner les différentes résolutions temporelles et spatiales accessibles.
Toutes ces études ont été effectuées en mode opérando c'est-à-dire pendant le fonctionnement de la batterie.
Exemple d’étude réalisée sur le système LiFePO4-FePO4 comme électrode positive.
Preuve DRX/XAS d’un retard apparent (CRISTAL/SAMBA&ODE)
LiFePO4 est un matériau d’électrode positive très étudié et actuellement en phase de commercialisation. Un retard dans la transformation structurelle de LiFePO4 en FePO4 a été observé par DRX pour la première fois par un groupe de chercheurs taïwanais [2]. Par la suite, l’apparition d'une phase amorphe avait alors été avancée comme explication de ce retard [3]. Cependant nos premiers résultats, obtenus également en DRX, ont réfuté l’existence d’une phase amorphe, puisque l’ajustement précis des intensités des raies de diffraction recueillies en mode operando tend à prouver qu'aucune phase amorphe n’a été créée, la disparition de la phase LiFePO4 correspondant à la formation de la phase délithiée FePO4 durant le processus biphasé de charge.
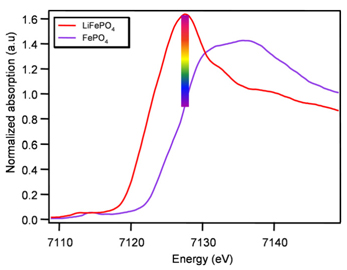
Nos premières expériences en XAS sur SAMBA ont aussi confirmé ce retard de réaction. La présence de points isobestiques bien définis, obtenus sur les courbes d’évolution des spectres enregistrés au seuil K du Fer pendant la décharge et la charge de l’électrode, est une signature claire de la nature biphasée du système. En conséquence, les spectres obtenus pour toutes les compositions comprises entre LiFePO4 et FePO4 sont des combinaisons linéaires des spectres de ces composés initial et final. L’évolution des proportions des deux phases, extraite des résultats des combinaisons linéaires, confirme ce retard apparent. Cependant la XAS est une technique qui n'est pas sensible à l'état cristallin du matériau étudié, et encore une fois dans notre cas la formation d’une troisième phase amorphe, dans une quantité relativement importante, ne peut pas simplement expliquer ce retardé observé.
Nous avons alors supposé qu’il existait dans l’électrode des parties « en avance » sur la transformation de phase, de façon à respecter la composition globale de l’électrode donnée à chaque instant par la mesure électrochimique. Afin de sonder cette hétérogénéité de l'électrode, nous avons simplement retiré, en boîte à gant sous atmosphère contrôlée, l'électrode de la cellule expérimentale après avoir atteint la composition électrochimique globale Li0.5FePO4. Ensuite nous avons sondé par XAS quatre positions bien distinctes sur l’électrode placée dans une enceinte étanche à l’air et à l’humidité.
Toutes les positions examinées présentent des spectres différents, qui différent également du spectre théorique. Deux points étaient « en retard » et deux autres légèrement en avance.
Comme ces spectres ont été collectés sur une électrode à l’équilibre thermodynamique, nous avons trouvé important d'examiner le comportement de ces électrodes LiFePO4 pendant le cyclage en plusieurs points et donc avec un plus petit faisceau. Ainsi des mesures ont été effectuées sur la ligne ODE, avec un spectre obtenu chaque 0,1 s avec une taille de faisceau inférieure de trois ordres de grandeur. Un déplacement de l'électrode pendant les mesures permet de sonder simultanément l’avance ou le retard et donc l'hétérogénéité corrélée. Sept points différents ont été examinés pendant le fonctionnement de la batterie et là encore les données montrent clairement des différences de comportement d’un point à l’autre confirmant l'hétérogénéité de l'électrode.
Une observation importante à relever est que, même si certains points étaient très en retard, tous les points étudiés atteignent finalement la composition électrochimique globale correspondant à la fin de la charge, prouvant qu’à cette échelle les grains ou ensemble de grains (étudiés en ces points) sont reliés au réseau électronique et ionique, même si chacun est relié d'une manière plus ou moins efficace.
Cartographie de l'électrode (LUCIA)
Comme nous avons montré par XAS que l'apparent « retard » est une conséquence de l'hétérogénéité de diffusion des ions Li+ ou des électrons, nous avons voulu étudier l’hétérogénéité de l’électrode en réalisant une cartographie en fonctionnement. Nous avons entrepris des expériences de cartographie sur LUCIA, spécialement conçue pour de telles expériences avec un déplacement contrôlé de l'échantillon et un petit faisceau (7x7 µm2). Cette ligne est équipée d'un monochromateur pas à pas classique qui n'est pas approprié pour la collecte rapide de données. En fait, un spectre complet de XANES, comme ceux indiqués sur la Fig. 1, serait enregistré en environ 5 minutes ce qui n'est pas approprié pour nos études dynamiques. De plus, une cartographie complète d’électrode représente environ 1300 points ce qui prendrait plus de 4 jours d’acquisition pour une seule composition, une durée incompatible avec l'utilisation de toute source de rayonnement synchrotron.
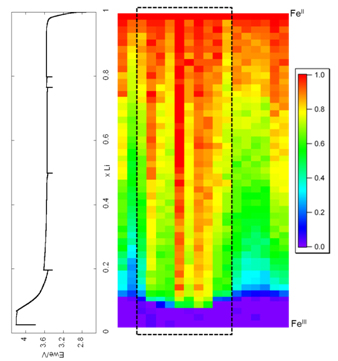
Par conséquent, nous avons effectué des expériences à une énergie fixe pour cartographier les électrodes, soit pendant leur fonctionnement (3 s par point), soit à différents états d'équilibre. Cette étude à énergie fixe est possible parce que le processus à étudier est une réaction biphasée qui implique qu’à toute énergie, l'intensité de l'absorption enregistrée est la combinaison linéaire de l'intensité des phases initiale et finale, et qui permet une mesure directe du rapport FeII/FeIII. Nous avons choisi l’énergie correspondant au maximum de différence d’intensité entre état initial et final. Dû au fait que l’intensité de l’absorption est également corrélée à la densité de l’élément sondé (ici le fer) présent en chaque point de l’électrode, il est nécessaire de mesurer cette densité en chaque point avant le démarrage du cycle puis de normaliser les données obtenues par ces valeurs initiales.
L'électrode a été sondée avec une résolution spatiale de 7 x 7 µm2. La couleur choisie est le rouge pour FeII (LiFePO4) et violet pour FeIII (FePO4).
Les données ont été recueillies en même temps dans le mode de transmission, à travers un trou dans la cellule, et en mode de fluorescence sur toute la surface de l’électrode. En transmission, seulement 12,5 mm2 de l’électrode peuvent être cartographiés mais la carte est représentative de l'épaisseur totale de l'électrode. En fluorescence, la totalité de la surface de l'électrode positive peut être étudiée, mais seulement à environ 7 µm de profondeur. La Fig. 2 représente les cartes obtenues en fluorescence en mode dynamique pendant la charge pour l’extraction d’un ion lithium en une heure. La distribution de la proportion de FeII est clairement hétérogène avec certaines parties de l'électrode contenant plus de LiFePO4 que prévu, alors que d’autres endroits en contiennent moins. Nous avons également observé une nette influence du trou de la cellule expérimentale (lignes en pointillés). C'est probablement dû à la différence de pression appliquée à la position du trou où le contact électrique avec le collecteur de courant est moins efficace. Dans ce cas, l'hétérogénéité est attribuée à un transfert d'électrons limité. Cette observation importante fournit une explication raisonnable du retard apparent observé en transmission par XRD par plusieurs auteurs : la zone exposée pour XRD montre un « retard » causé par un plus petit contact électrique (plus petite pression) au centre de l'électrode.
La forte influence du régime sur l'hétérogénéité de l'électrode a aussi été mise en évidence grâce à de telles cartographies, de plus amples informations sont disponibles dans l’article (G. Ouvrard, M. Zerrouki, P. Soudan, B. Lestriez, C. Masquelier, M. Morcrette, S. Hamelet, S. Belin, A. M. Flank, F. Baudelet J. of Power Sources 229 (2013) 16-21).
Références :
[1] J.B. Leriche, S. Hamelet, J. Shu, M. Morcrette, C. Masquelier, G. Ouvrard, M. Zerrouki, P. Soudan, S. Belin, E. Elkaïm, F. Baudelet, J. Electrochem. Soc. 157 (2010) A606-A610.
[2] H.H. Chang, C.C. Chang, H.C. Wu, M.H. Yang, H.S. Sheu, N.L. Wu, Electrochem. Comm. 10 (2008) 335-339.
[3] H.C. Shin, K.Y. Chung, W.S. Min, D.J. Byun, H. Jang, B.W. Cho, Electrochem. Comm. 10 (2008) 536-540.
Le mécanisme du NbSnSb, un nouveau matériau d'électrode négative pour les batteries Li-ion (SAMBA)
Le TiSnSb, récemment testé comme électrode négative dans les batteries Li-ion, s'est avéré un matériau d'électrode extrêmement prometteur avec une capacité supérieure à 500 mAh/g pendant plus de 250 cycles même à des vitesses de cyclage élevées (4C), et avec une excellente efficacité coulombique de 99 %. [1;2]
À partir de mesures par DRX et spectroscopie Mössbauer operando, un mécanisme de conversion conduisant simultanément à la formation des alliages Li3Sb et Li7Sn2 a été observé, mais aucune information au sujet du Ti n’a pu être obtenue. Une reconversion lors de la charge a été mise en évidence. Elle produit un alliage structurellement proche du matériau de départ, mais encore indéfini. En outre, les bonnes performances électrochimiques du TiSnSb (par comparaison avec Sn, Sb ou SnSb) seraient corrélées à la présence du métal non actif (par rapport à Li), c'est-à-dire de Ti. Parmi les rares phases ternaires dans le système M/Sn/Sb (M = métal de transition), seul NbSnSb présente la même stœchiométrie que TiSnSb et un arrangement structural proche.
L’équipe de AIME de l’Institut Gerhardt de Montpellier a décidé d'explorer le système entier Ti1-yNbySnSb avec 0 ≤ y ≤ 1 afin de mieux comprendre le rôle joué par le métal de transition, tant dans le mécanisme que dans les performances de la batterie. Les mesures XANES et EXAFS sur la série entière de Ti1-yNbySnSb ont été réalisées avant et pendant le cyclage de la batterie (avec la cellule conçue spécialement dans le cadre du projet ANR PULSSE).
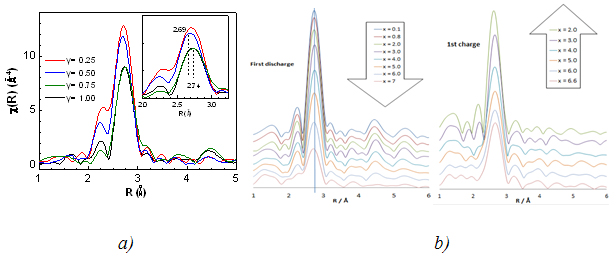
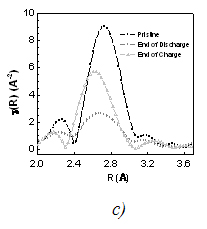
Les spectres au seuil K normalisés pour tous les échantillons de Ti1-yNbySnSb sont assez semblables, ce qui signifie que le Nb reste approximativement dans le même état électronique. La distribution pseudoradiale dérivée des signaux EXAFS (Fig 1a) montre que le pic principal est centré sur 2,69 Å pour le Ti1-yNbySnSb avec y = 0,25 et 0,5, et plutôt sur 2,74 Å pour le Ti1-yNbySnSb avec y = 0,75 et 1. Cette tendance est en accord avec le fait que les distances M-M et M-Sn/Sb sont légèrement plus faibles pour M = Ti que pour M = Nb, si et seulement si l’on considère l'existence d'une phase unique constituée de domaines cristallographiques de structure tétragonale (type NbSnSb) et orthorhombiques (type TiSnSb). À noter que la mesure DRX n'a pas pu donner d'informations claires sur la composition de phase des différents échantillons de Ti1-yNbySnSb. Le seuil K du Nb reste relativement inchangé pendant la décharge/charge de l'électrode à base de NbSnSb (Fig 1b). L'analyse de la fonction de distribution pseudoradiale (Fig 1c) à différentes étapes du cyclage de la batterie NbSnSb/Li montre que le pic large (en noir) centré sur 2.73 Å correspondant aux liaisons Nb-Nb, Nb-Sn et Nb-Sb dans le NbSnSb de départ disparaît lors de la décharge pour laisser la place à un autre pic large centré sur 2,68 Å qui pourrait correspondre à une liaison Nb-Nb dans une phase de niobium métal de structure cubique. Le meilleur ajustement a été obtenu en ajoutant un atome de Sb (ou Sn) à la première sphère de coordination du Nb (dans la maille cubique de niobium). Ceci est en accord avec le diagramme de phase Nb/Sb qui présente une solution solide de 4 % mol. de Sb par mole de Nb. Après la charge, le pic large centré sur 2,68 Å est difficile à ajuster.
L'analyse EXAFS a contribué à démontrer que le Ti1-yNbySnSb consiste en des phases uniques formées de domaines cristallographiques de TiSnSb-NbSnSb dans diverses proportions en fonction de la composition de Ti/Nb. La réversibilité du mécanisme électrochimique a pu être démontrée à partir des spectres enregistrés en mode operando. D'autre part, pour la première fois dans l'étude d'un matériau de type conversion, il a été montré qu'une faible quantité de Sb (et/ou de Sn) provenant de la matrice de Li3Sb (ou LixSn) diffuse dans les nano particules du métal de transition (Nb dans le cas présent) dans l'électrode entièrement déchargée, ce qui démontre la forte métastabilité de l'électrode dans cet état déchargé.
Références :
[1] M.T. Sougrati, J. Fullenwarth, C. Marino, B. Fraisse, J.C. Jumas, L. Monconduit J. Mater. Chem., 2011, 21 (27), 10069 - 10076
[2] H. Wilhelm, C. Marino A. Darwiche, L. Monconduit, B. Lestriez Electrochemistry Communications 24, 2012, 89–92