DISCO

DISCO est une ligne de lumière couvrant la gamme VUV-visible, dédiée à la biologie et la chimie. La gamme spectrale est optimisée entre 60 et 700 nm, avec conservation de la polarisation naturelle de la lumière.
DISCO est composée de deux stations expérimentales : SRCD (dichroïsme circulaire avec le rayonnement synchrotron) et Imagerie UV.
Les actualités de la ligne
Toutes les actualités de la ligne
Highlights de SOLEIL 2024

Que peut apporter SOLEIL à la communauté scientifique des biologistes - Rencontres (...)
L'équipe



* Prestataire extérieur, intérimaire ou collaborateur
Actualités en vidéos
Toutes les vidéos de DISCO
Le lin, d’hier à aujourd’hui
Les lumières de SOLEIL (VFSTF et LSF) (2/3)
Photo Disco team et Associés

Associés
Marie-Françoise Devaux : IR INRA - chimiométricienne
Données techniques
- Optiques
-
Flat and toroid mirrors with a cold finger just before for M0. Beam divided in three for the endstations.
- Source
-
Dipole Radiation: 40 mrad H x 10 mrad V
- Par branche
-
BRANCHE
SRCD
POLYPHEME
Domaine d'énergie
120-400 nm
180-1000 nm
Résolution en énergie
0.1 nm
0.5 nm
Flux @ first optical element
10 e+14 Phot/s/0.1%bw @ 100 nm
Environnement échantillon
Cellules en CaF2
Inverted microscope
with spectral and temporal
resolutions with controled
temperature and CO2Taille de faisceau sur l'échantillon
4x4 mm2
0.1x0.1 μm2
Detecteurs
PMTs
PMTs, time gated CCD
- Polarisation
-
Circulaire
- Optical design
-
DISCO beam is extracted from a dipole : D04.1 (1.71 T). A 40 per 10 mrad opening is taken.
- Setup
-
The imaging endstation comprises two inverted microscope with pre and post monochromators and three detectors : one PMT, one phase gated CCD camera and one APD.
The CD endstation comprises one optical bench with a photoelastic modulator, a sample holder and a PMT.
- Other facilities
-
A tiny lab dedicated and very close to DISCO includes a cell laboratory and a mini biochemistry lab.
The huge biochemistry lab for users is located closely undercover from the beamline.
Thématiques scientifiques
| Material sciences | Microscopic Analysis defaults inside optical materials ; prebiotics and fossils inclusions topology inside geological materials. |
|---|---|
| Biochemistry | Proteins and DNA structures and dynamics ; sugar structures |
| Biology , Biomedics | Imaging biochemical reactions inside individual cells with fluorescent proteins; Autofluorescence of tumoral cells and tissues; Study of drug distribution inside human tissues without additional labelling ; diagnosis of hydrophobic molecules |
DISCO is a VUV to visible beamline of phase 2. First users were received in september 2009.
Three endstations are operated around a common scientific topic : Biomolecular investigations, with special emphasis on proteins, particularly membrane proteins:
- A circular dichroism endstation in the VUV range which opens new fields in the investigation of biological molecules, with, in particular, the possibility to follow rapid kinetics such as proteins folding and unfolding in real time,.
- An endstation for mass spectrometry of non-soluble molecules based on VUV photoionization with new opportunities for proteomics and photochemistry of hydrophobic molcules.
- An imaging endstation for biological (living cells) and material applications with new possibilities of excitation and detection, also allowing biomedical investigation of normal and tumoral tissues moreover, new paradigms in autofluorescence diagnosis appear and "abandonned" molecules that fluoresce only in the UV can be used as probes.
Voir aussi la section scientifique à SOLEIL : HelioBio
IMAGING
Information technique sur la branche Imagerie
SR-CD/OCD
Information technique sur la branche SR-CD/OCD
 1. SRCD permet d’enregistrer des spectres de dichroïsme circulaire en solution jusqu’à 165 nm même avec des tampons très absorbants et en films jusqu’à 120 nm. Acquisition très rapide de données sur le repliement et la stabilité.
1. SRCD permet d’enregistrer des spectres de dichroïsme circulaire en solution jusqu’à 165 nm même avec des tampons très absorbants et en films jusqu’à 120 nm. Acquisition très rapide de données sur le repliement et la stabilité.
2. IMAGERIE : deux microscopes à disposition (un wiki)
- un premier microspectrofluorimètre, POLYPHEME, pour enregistrer des images d’excitation ou d'émission de fluorescence de molécules absorbant de 190 à 400 nm. Permet également d’enregistrer des spectres issus de nanovolumes uniques.
- un deuxième microscope plein champ, TELEMOS, avec support en z porte objectifs motorisé pour l’imagerie rapide de cellules vivantes par exemple :
- De nombreuses molécules fluorescent lorsqu'elles sont excitées avec des ultraviolets (entre 190 et 400 nm), voici quelques exemples que nous avons rencontrés : les acides aminés aromatiques bien sûr, mais aussi le NADH, la DHE (qui peut remplacer le cholestérol dans les études membranaires), les acides féruliques, la lignine, les quadruplexes de G, les polyènes, ...
- Beaucoup d'oxydes métalliques (ZnO, TiO2) luminescent après une excitation UV
- Un certain nombre de médicaments et d'agents de contraste présentent une fluorescence naturelle après excitation UV
SRCD
La branche SRCD de la ligne DISCO propose une station de mesure du dichroïsme circulaire dans l’ultraviolet violet basée sur l’absorption du rayonnement synchrotron.
Référence de la branche : M. Réfrégiers, F. Wien, H.-P. Ta, L. Premvardhan, S. Bac, F. Jamme, V. Rouam, B. Lagarde, F. Polack, J.-L. Giorgetta, J.-P. Ricaud, M. Bordessoule and A. Giuliani DISCO synchrotron-radiation circular-dichroism endstation at SOLEIL J. Synchrotron Rad. (2012). 19, 831-835
Avantages du SRCD
L’utilisation du rayonnement synchrotron permet d’étendre vers les basses longueurs d’onde le domaine spectral en comparaison avec un appareil de laboratoire. Typiquement, un appareil de laboratoire permet d’atteindre 190 nm alors que l’utilisation rayonnement synchrotron peut permettre d’aller jusqu’à 160 nm, voir figure 1. Au delà, les solvants deviennent opaques.
Analyse des données
Nous vous recommandons fortement d'utiliser BestSel une nouvelle méthode très fiables pour la détermination de structures scondaires à partir de spectres CD et la reconnaissance de repliements des protéines. Les informations détaillées sur l'algorithme se trouvent dans Micsonai et al., Proc. Natl. Acad. Sci. USA (2015) doi:10.1073/pnas.1500851112.
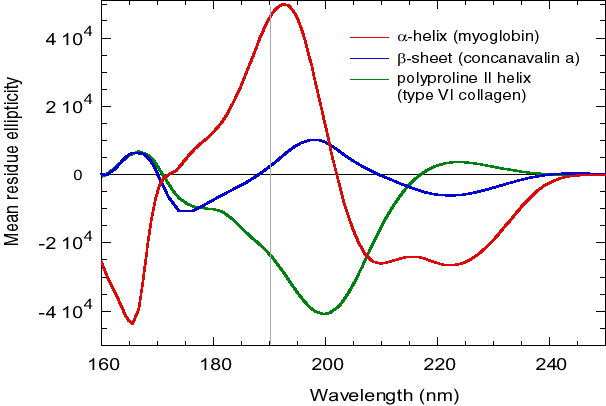
La grande brillance (ou luminance) du rayonnement synchrotron permet de travailler sur des échantillons turbides ou opaques.
Informations utiles
Les échantillons sont chargés dans des cellules de CaF2, matériau transparent dans le VUV. Les trajets optiques vont de 2,5 μm à 50 μm.
En règle générale, plus l’échantillon sera concentré, plus le trajet optique sera faible et plus les petites longueurs d’onde seront accessibles.
Les concentrations typiques vont de 0,1 à 10 mg/ml.
On utilise quelques microlitres suivant le trajet optique choisi : de 0.5 μl à 15 μl pour les cellules de 2.5 μm et 50 μm, respectivement.
Certains tampons et sels absorbent dans l’UV et sont donc à remplacer. La tableau ci-dessous, adapté de Franz X. Schmid, p. 251 « Protein structure – a practical approach », IRL Press, Oxford 1989, donne les absorbances de sels et tampons à 0.01 M dans des cellules de 0,1 cm.
| Substance | transparent jusqu'à | abs 200 nm | abs 180 nm |
|---|---|---|---|
| NaClO4 | 170 nm | 0 | 0 |
| NaF, KF | 170 nm | 0 | 0 |
| Ac. Borique | 180 nm | 0 | 0 |
| NaCl | 205 nm | 0.02 | >0.5 |
| Na2HPO4 | 210 nm | 0.05 | >0.5 |
| NaH2PO4 | 195 nm | 0 | 0.15 |
| Na Ac. | 220 nm | 0.17 | >0.5 |
| Glycine | 220 nm | 0.1 | >0.5 |
| Diethyl Amine | 240 nm | >0.5 | >0.5 |
| NaOH | 230 nm | >2 | >2 |
| AcideBorique-NaOH | 200 nm | 0 | 0.3 |
| Tricine | 230 nm | 0.44 | >0.5 |
| Tris | 220 nm | 0.13 | >0.5 |
| Hepes | 230 nm | 0.5 | >0.5 |
| Pipes | 230 nm | 0.5 | >0.5 |
| Mops | 230 nm | 0.34 | >0.5 |
| Mes | 230 nm | 0.3 | >0.5 |
| Cacodylate | 210 nm | 0.2 | >0.5 |
Bientôt, ici, un logiciel avancé pour l'analyse des spectres de dichroïsme circulaire: CiDiPy
IMAGERIE
 Vous pouvez trouver des astuces sur l'utilisation des microscopes de DISCO, vous trouverez ici quelques informations vous permettant de mieux appréhender les expériences possibles sur DISCO.
Vous pouvez trouver des astuces sur l'utilisation des microscopes de DISCO, vous trouverez ici quelques informations vous permettant de mieux appréhender les expériences possibles sur DISCO.
Les deux microscopes reçoivent une lumière monochromatique sélectionnable rapidement entre 200 et 600 nm. Le premier, POLYPHEME, est dédié à la microspectroscopie de fluorescence UV, le deuxième, TELEMOS, à l'imagerie plein champ UV.
Référence: Jamme, F., Villette, S., Giuliani, A., Rouam, V., Wien, F., Lagarde, B., & Refregiers, M.Synchrotron UV Fluorescence Microscopy Uncovers New Probes in Cells and Tissues. Microscopy and Microanalysis, 2010, 16(5): 507-514
Préparation des échantillons :
Les deux microscopes sont des statifs inversés, le premier est un IX71, le deuxième un axioobserver Z1. La plupart des échantillons seront donc placés tête en bas avec une lamelle couvre objet en quartz. Les deux objectifs principaux sont à immersion à glycérine, il est également possible d'utiliser des objectifs à air à longue distance de travail.
- Cellules
Nous possédons une cellule attofluor (Invitrogen). Elle permet de recevoir des cellules qui ont poussé sur une lamelle ronde en suprasyl (nous contacter si vous désirez recevoir de telles lamelles). Si vous possédez vos propres chambres d'incubation, n'hésitez pas à nous contacter. - Tissus
Nous conseillons de déposer les biopsies ou coupes sur des lames sans monter de lamelles sauf si vous avez des lamelles UV. Les épaisseurs peuvent varier entre 1 et 10 µm environ, pour des demandes spécifiques n'hésitez pas à nous contacter. Certains milieux de montage transparents aux UVs peuvent être utilisés. - Protocole de fixation (d'après Slavka Kascakova) :
- Before seeding the cells on quartz slides, the slides need to be sterile. It's sufficient to sterilize them with 70% of EtOH (let slides from 30 min - 1 hour in 70% of EtOH and then let them dry under the flow). You can eventually, once the slides are dried, let them under the UV light for 30 min.
- Afterthat the quartz slides are placed into the well plates or Petri dish and cells are deposit on it with its culture medium. The plate is then placed into the incubator with 5% CO2 and 37°C. We are making sure that cells nicely adapt on slide and proliferate.
- Individual cell treatment.....Incubation with nanoparticles, drug or whatever product for different periods. After incubation, cells are washed with PBS or medium without FCS.
- Cell treatment is followed by fixation for microscopic observation: Slide is gently removed from well and placed into the Petri dish with 4 % formalin in PBS for 20 min at room temperature. After this period, cells are then washed for 5 seconds with distilled water, to remove the residual PBS from the surface of the cells. The cells are then dried under ambient conditions and stored in fridge at 4°C. (For drying process, one can eventually deposit the slides on Whatman lens cleaning tissue (http://www.whatman.com/PRODLensCleaningTissue.aspx) (Whatman paper leaves no fibers and it's not damaging optical surfaces). It's also important to mention, that manipulation with slide should be very gentle - very easily one can do scratches on the surface of slide or break the slide.
Platine PI de POLYPHEME
PI 542.2CD – 80x80 mm aperture – 100x100 μm travel range
Liste des objectifs
| 40x Ultrafluar Zeiss Glyc N.A: 0.6 Working distance: 0.36 Features: Infinity corrected | 100x Ultrafluar Zeiss Glyc N.A: 1.25 Working distance: 0.17 Features: |
| 40x OFR LMU N.A: 0.5 Working distance: 1 mm Features: Infinity corrected | 10x Ultrafluar Zeiss N.A: 0.2 Working distance: 7.4 Features: Infinity corrected |
Liste des filtres accessibles sur TELEMOS :
- Dichroïques
DM300, DM400, DM505 - Passe-bandes et passes-hauts
Un panel de filtres passes bandes à l'émission sont utilisables. Ce sont des filtres 1" provenant de chez Omega Filters. Vous pouvez aussi amener vos propres filtres ou discuter avec l'équipe de ligne pour des achats spécifiques pouvant profiter au plus grand nombre.
| Nom | XF1000 | XF3000 | XF1076 | QMAX/EM420-480 | XF3075 | QMAX/EM510-560 | XF3085 |
|---|---|---|---|---|---|---|---|
| Description | OMEGA | OMEGA | OMEGA | OMEGA | OMEGA | OMEGA | OMEGA |
| Nom | XF1009 | QMAX/EM600-650 | QMAX/EX355-405 | QMAX/EX530-570 |
|---|---|---|---|---|
| Description | OMEGA | OMEGA | OMEGA | OMEGA |
Liste des fluorochromes excitables en UV :
• Pour une liste détaillée de fluorochromes endogènes, nous vous conseillons de consulter :
Wagnieres G.A., Star W.M. and Wilson B.C. (1998) ln Vivo Fluorescence Spectroscopy and Imaging for Oncological Applications. Photochem. Photobiol. 68, 603-632
Les logiciels utilisés sur les deux microscopes :
- Pour l'acquisition de données
- En microspectrofluorimétrie : Labspec
- En imagerie plein champ et 3D : µManager - Pour l'analyse
Pour le traitement d'images spectrales :
- Labspec
- Matlab
Pour le traitement d'images 2D : ImageJ
Pour la déconvolution d'images et la reconstruction d'images 3D: Huygens
Recording mosaïcs
1- In micromanager, check that the pixel size is calibrated
| Objective | Pixel size |
|---|---|
| 10x zeiss ultrafluar | 1.2 um |
| 100x zeiss ultraflar | 0.153 um |
| 40x Zeiss Ultrafluar | 0.313 um |
2- perform slide explorer until you obtain the area of interest in transmission mode, save it
3- define a rectangle (ROI) with imageJ tools and click on ROI -> POS
4- launch a multidimensionnal acquisition with multiposition on but only one filter.
How to perform mosaïcs of images for large area mapping on TELEMOS microscope at DISCO Beamline:
Recording mosaïcs
1- In micromanager, check that the pixel size is calibrated (! for a binning of 1)
| Objective | Pixel size |
|---|---|
| 100x zeiss ultrafluar | 0.153 um |
| 40x zeiss ultraflar | 0.313 um |
| 10x Zeiss Ultrafluar | 1.2 um |
2- perform slide explorer until you obtain the area of interest in transmission mode, save it
3- define a rectangle (ROI) with imageJ tools and click on ROI -> POS
4- launch a multidimensional acquisition with multiposition on but only one filter.
Stitching mosaic
1- you will first need to reorder your data, this can easily be made by opening the saved folder in micromanager and clicking on save stack
2- in FIJI, use the plug-in:Stitchin:Deprecated:Stitch sequence of grid of images
3- use the following options : overlap 12% for the 10x.
4- for post-treatment of mosaics, we recommend the use of BaSiC
That's it !
Do not forget to save the result.
Soon here: ICY protocols for image analysis; because, as ICY's team, we believe in reproducible research.
DISCO reçoit des utilisateurs depuis septembre 2009 sur ses trois stations expérimentales. L'utilisation du rayonnement synchrotron ultraviolet permet d'observer en solution, dans les cellules ou dans les tissus les biomolécules en interactions.
Communautés
Aide Soumission Projets
- N'oubliez pas de contacter un des scientifiques de la ligne.
- Les domaines d'énergies dépendent des branches
- Les environnements échantillons sont définis avec les scientifiques de ligne.
- La justification du temps de faisceau demandé est cruciale.
- Comment citer la ligne et SOLEIL dans vos articles après les expériences ?
Nous vous recommandons de
• Citer la ligne dans les matériels et méthodes (DISCO beamline), avec la référence à Giuliani et al, Journal of Synchrotron Radiation 2010;
• Citer la branche sur laquelle vous avez travailler avec la référence en rapport;
• Remercier SOLEIL dans les acknowledgement, avec le ou les numéros de projets liés à vos expériences;
• Remercier le local contact si vous le souhaitez.
N'oubliez pas de mentionner vos publications liées à la ligne dans le sunset.
Websites & publications of interest
- Sur le CD
- Protocoles d'analyse
- Petit cours de CD - Sur la spectrométrie de masse
- BIBs Platform
- Mass spectrometry lessons (in french) - Sur l'imagerie de fluorescence
- SYCLOPS
- Réseau d'Imagerie Cellulaire Paris XI
- Réseau Technologique de microscopie photonique du CNRS - Site INRA dédié aux expériences sur synchrotron
http://www.inra.fr/inra_cepia/vous_recherchez/des_plates_formes_et_des_outils/soleil
Nos utilisateurs ont du talent...
- CNRS Le Journal a tourné autour d'une manip sur DISCO: https://lejournal.cnrs.fr/videos/le-mystere-de-lamulette
- Katrien Keune et Annelies van Loon ont fait le voyage d'Amsterdam jusqu'à DISCO dans https://www.dekennisvannu.nl/site/media/Science4Arts-Een-gezonde-samenwerking/6217
- Stéphane Pallu et Gaël Rochefort de l'Inserm (CHRO, Orléans) ont tourné un film sur leur travail à DISCO : L'Ostéoporose à la lumière de SOLEIL
- Béatrice Matot (CEA Saclay) a gagné le prix du poster 2010 au user meeting de SOLEIL.
- Francis Canon (INRA, Montpellier) a réalisé un superbe reportage photo sur la ligne lors de sa construction.
Lexique
- DISCO: Dichroism, Imaging and mass Spectrometry for Chemical and biOlogical systems (Inspired author : L. Nahon)
- CD BIO: Old name of DISCO
- CD: Circular Dichroism
- SRCD: Synchrotron Radiation Circular Dichroism
- APEX: Atmospheric Pressure Photoionisation EXperiment
- POLYPHEME:Cyclop was already taken... this is DISCO Microscope nickname, son of Poseidon he does'nt know nobody
- TELEMOS: Another Cyclop with the gift of telling the future, son of Protée
- TARTARO: New Cyclop from the south of France
Sujets liés
Complementary beamlines at SOLEIL
DISCO experiments is complementary to SMIS (Infrared microscopy) for cellular biology. SRCD and Mass spectrometry are complementary to SWING, PROXIMA I and PROXIMA II for structural biology and biochemistry.
Other SRCD beamlines in the world
| B23, Diamond | UV1, ASTRID | 3m NIM1, BESSY2 | BL15, HiSOR |
| Oxon ,UK | Aarhus, Dk | Berlin, DE | Hiroshima, JP |
| BESSY 2 new | NSRL | CD12 revamped | 4B8,IHEP |
| Berlin, DE | Hefei, CHINA | Anka | Beijing, CHINA |
Les recherches développées par l'équipe concernent les interactions de la lumière avec les biomolécules. Elles sont soutenues par l'ANR, l'INRA, l'Union Européenne, la Région Centre, le PRES UniverSud.
Thèmes de recherche
 Les recherches développées par l'équipe concernent les interactions de la lumière avec les biomolécules. Elles sont soutenues par l'ANR, l'Union Européenne, la Région Centre et le PRES Universud.
Les recherches développées par l'équipe concernent les interactions de la lumière avec les biomolécules. Elles sont soutenues par l'ANR, l'Union Européenne, la Région Centre et le PRES Universud.
- Photochimie et photobiologie
- Protéines intrinsèquements peu structurées
- Suivi d'antibiotiques dans des bactéries individuelles
Voir aussi la section scientifique à SOLEIL : HelioBio
Financements
IMI : projet TRANSLOCATION
ANR : SRMS2, SOPOL, METABACT, REACTIV, deepOASES
ANS INRA
Participation à l'axe NBS de C'Nano, à l'axe E du RTRA Triangle de la Physique.
 |  |  |  |
Collaborations
- PAinT (Nederland)
- BIA (Nantes)
- UMR MD1 (Marseille)
- VIM INRA (Jouy en Josas)
- Géomicrobiologie, IPGP
- UMR 8601 (Paris V)
- IPCM (Paris VI) - H. Dossmann
Tutoriels Imageries
Tutoriels SRCD
Laboratoires




