Vue moléculaire d'un processus de transfert électronique essentiel à la biogénèse des protéines Fe-S
Les agrégats fer-soufre sont des cofacteurs omniprésents dans le Vivant. Constitués de fer et de soufre inorganiques ils sont essentiels au fonctionnement de protéines impliquées dans un grand nombre de fonctions : transport électronique dans les complexes de la chaîne respiratoire, photosynthèse, réponse à un stress oxydatif, apport en ions fer, réparation de l'ADN… Dans la plupart des protéines Fe-S, le ou les agrégat(s) se comporte(nt) comme un groupe de transfert électronique servant de médiateur aux réactions redox à un électron. Des équipes de l’Université de Florence ont étudié la reconnaissance entre 2 protéines clés impliquées dans l’assemblage des agrégats Fe-S de ces protéines.
Des pathologies liées à des défauts dans la biogénèse des agrégats Fe-S
Il est désormais clair que plusieurs maladies humaines rares et apparemment très différentes sont attribuables à des défauts dans le processus de base de biogénèse des agrégats Fe-S. Bien que ces maladies (qui incluent l'ataxie de Friedreich, la myopathie due à un déficit en ISCU, une forme rare d'anémie sidéroblastique, une encéphalomyopathie causée par un dysfonctionnement du complexe I de la chaîne respiratoire, et le syndrome de dysfonctionnement mitochondrial multiple) affectent différents tissus, une caractéristique commune à la plupart d'entre elles est le développement d'une surcharge en fer mitochondrial comme conséquence secondaire d'une biogénèse défectueuse des agrégats Fe-S.
Pour cette raison, la compréhension de la biogénèse des agrégats Fe-S revêt une importance capitale. Comme les protéines impliquées dans la biogénèse des agrégats Fe-S ont été conservées par l'évolution entre les bactéries et les humains, de nombreux détails moléculaires du processus de biogénèse des agrégats Fe-S proviennent d'études sur des organismes modèles, dont des bactéries, des champignons et des plantes.
Synthétiser ces agrégats nécessite des machineries complexes
Parce que les ions sulphides S2-, ferreux Fe2+ et ferriques Fe3+ sont toxiques in vivo, la biogénèse des agrégats de protéines fer-soufre constitue un processus hautement régulé qui sollicite des machineries protéiques complexes- elles sont au nombre de 3 dans les cellules eucaryotes. Deux protéines humaines clés, la diflavine oxydoréductase 1 (Ndor1) NADPH-dépendante et l'anomorsine, forment in vivo un complexe stable que l’on pense impliqué dans l'apport d'électrons au sein de la machinerie d’assemblage de protéines fer-soufre qui est présente dans le cytosol. Une implication de l'interaction Ndor1–anamorsine dans la régulation des mécanismes de survie/mort cellulaire a également été suggérée.
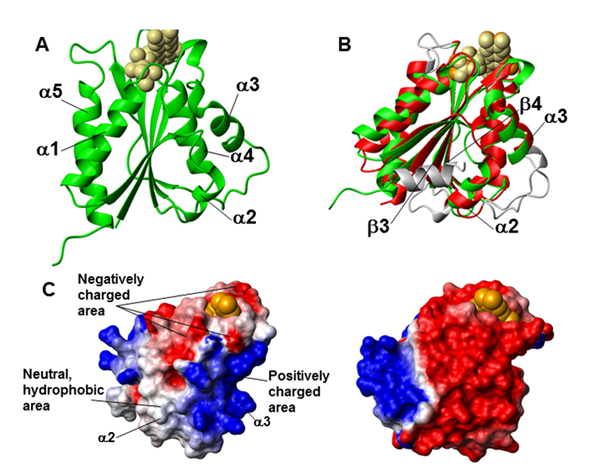
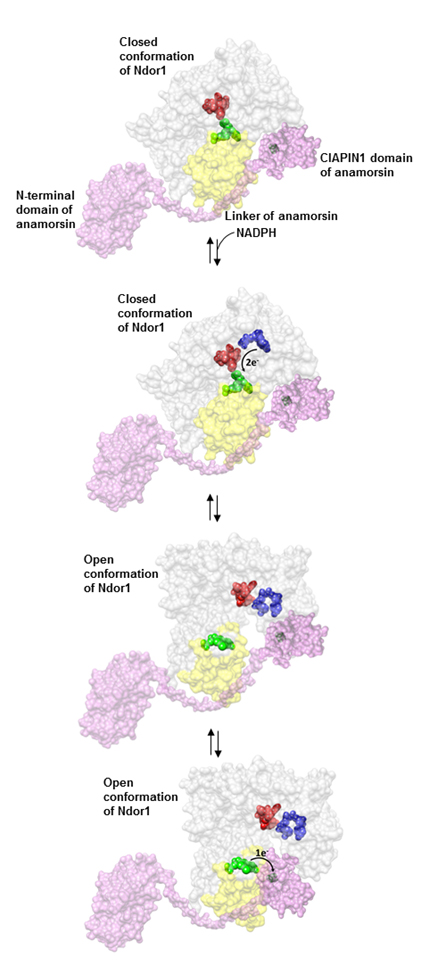
Dans cette étude, les chercheurs ont découvert la base moléculaire de la reconnaissance entre le domaine de liaison à la FMN de la Ndor1 et la région C-terminale (liaison et domaine CIAPIN1) de l'anamorsine contenant l'agrégat [2Fe- 2S] dans l'état oxydé, ainsi que celle du processus de transfert électronique. Ces conclusions sont basées sur la caractérisation structurale combinant RMN et diffraction des rayons X – expériences menées sur PROXIMA1- de la Ndor1 et de l'anamorsine (Fig. 1), sur l'étude du processus de transfert électronique (Fig. 2), et sur l'identification de ces régions de protéines jouant un rôle dans la formation de complexes et de celles jouant un rôle dans le transfert électronique.
Les chercheurs ont déterminé qu'une région non structurée de l'anamorsine était essentielle à la formation d'un complexe protéique spécifique et stable avec Ndor1, dans lequel la région C-terminale de l'anamorsine contenant le centre redox [2Fe-2S] interagit de manière transitoire, via des acides aminés complémentaires chargés, avec la région du site de liaison à la FMN de la Ndor1, afin d’effectuer le transfert électronique.
Le modèle moléculaire du processus de transfert électronique proposé fournit des informations significatives sur les processus fonctionnels dans lesquels l'interaction Ndor1-anamorsine est impliquée, c'est-à-dire l'assemblage d'agrégats de fer-soufre (1), de protéines diferriques (2) et la régulation des mécanismes de survie/mort cellulaire (3,4). En effet, la perturbation de l'interaction stable entre l'anamorsine et la Ndor1 pourrait provoquer l'interruption du flux d'électrons entre les deux protéines au sein de la cellule et par conséquent abolir cette fonction essentielle pour la survie de la cellule, conduisant ainsi à l'activation des mécanismes de mort cellulaire.
Références
1. Dukor RK, Keiderling TA. (1991) Biopolymers 31(14):1747.
2. Arnesano F, et al. (2003) J Am Chem Soc 125(24):7200.
3. Shen Yet al. (2009) J Biomol NMR 44(4):213.
4. Bertini I, et al. (2001) J Biomol NMR 21(2):85.