Une nouvelle cible pour traiter le virus mpox (variole du singe) et d’autres infections poxvirales
Le mpox est une maladie infectieuse transmise par contact, pouvant être mortelle ou laisser des séquelles importantes. Des chercheurs de l’Institut Pasteur ont identifié et caractérisé une nouvelle cible pour développer des thérapies capables de neutraliser le virus et de protéger contre la maladie.
En utilisant des données structurales obtenues à SOLEIL sur le cryomicroscope électronique POLARIS et sur les lignes de lumière PROXIMA-1 et PROXIMA-2A, ils ont montré comment certaines protéines virales et des anticorps neutralisants bloquent l’entrée du virus, puis ont utilisé ces données structurales pour générer une nouvelle molécule qui a induit des réponses immunitaires protectrices chez la souris.
Le virus de la variole du singe est responsable du mpox, une maladie humaine grave étroitement apparentée à la variole. Historiquement, le mpox est une zoonose1 qui provoque des flambées récurrentes en Afrique centrale et occidentale ; cependant, depuis 2022, deux souches adaptées à la transmission interhumaine ont entraîné des épidémies d’ampleur inhabituelle, se propageant à travers plusieurs pays et continents. Les vaccins de première génération utilisés pour éradiquer la variole sont basés sur des souches virulentes et ne sont, de ce fait, pas considérés comme sûrs selon les normes médicales actuelles. Les vaccins atténués modernes sont coûteux, et n’offrent qu’une protection de courte durée. Quant au tecovirimat, l’unique antiviral disponible pour traiter le mpox, il s’est révélé inefficace pour réduire les symptômes ou la gravité de la maladie dans de nombreux essais cliniques. Par conséquent, il existe actuellement un manque d’outils thérapeutiques efficaces pour contenir les épidémies de grande ampleur de mpox et d’autres poxvirus, ce qui a conduit l’OMS à déclarer le mpox urgence de santé publique de portée internationale.
Des scientifiques de l'Institut Pasteur, avec l'aide des équipes de plusieurs lignes de lumière de SOLEIL, se sont attaqués à ce problème. Début 2025, à partir de données recueillies sur les lignes PROXIMA-1, PROXIMA-2A et SWING, ils ont avancé dans la compréhension du mode d’action du tecovirimat en montrant qu’il empêche la sortie du virus en induisant la dimérisation d'une phospholipase virale appelée F13. Ils ont également publié la structure 3D du complexe F13/tecovirimat, ouvrant ainsi la voie au développement de nouveaux antiviraux.
Plus récemment, ils se sont intéressés à la manière dont le virus mpox pénètre dans les cellules. L’une des pistes thérapeutiques les plus prometteuses pour développer des antiviraux est une famille de protéines qui interviennent dans l'entrée du virus, appelées « complexes de fusion », qui n'ont pas été suffisamment étudiées chez les poxvirus en raison de leur complexité. Dans leur étude dont les résultats ont été publiés dans le journal Cell, les scientifiques de l'Institut Pasteur ont étudié l'A16/G9, une partie du complexe de fusion du virus qui joue un rôle crucial dans le choix des cellules à infecter et le moment de l'infection.
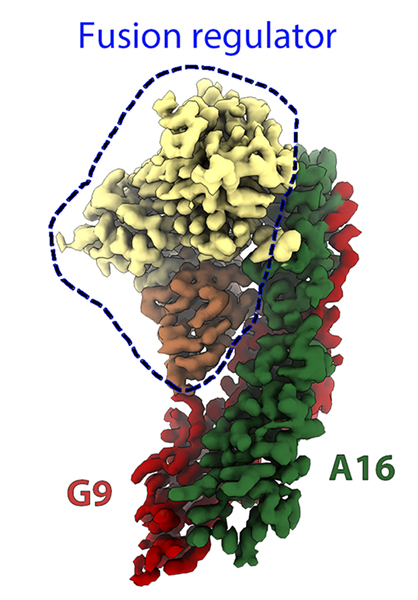
Ils ont conçu un complexe stable qui imite la structure de l'A16/G9 sur la particule virale. Ils ont ensuite utilisé le nouveau cryo-microscope électronique POLARIS disponible à SOLEIL (financé par EQUIPEX et l'ANR (ANR-21-ESRE-0046)) pour obtenir la structure 3D de A16/G9 en complexe avec un autre complexe de protéines du virus, dont le rôle est d'empêcher la surinfection (c'est-à-dire l'infection d'une cellule déjà infectée) (figure 1). Cette structure a montré comment les deux complexes protéiques viraux interagissent, ouvrant de nouvelles perspectives pour le développement d'une nouvelle classe d'antiviraux et confirmant que le complexe A16/G9 modifié acquiert une conformation biologiquement pertinente.
Ensuite, ils ont injecté le complexe A16/G9 à un alpaga, dont le système immunitaire a réagi en produisant des antigènes qui se sont révélés capables de neutraliser plusieurs poxvirus, y compris les deux souches de mpox pouvant infecter l'homme.
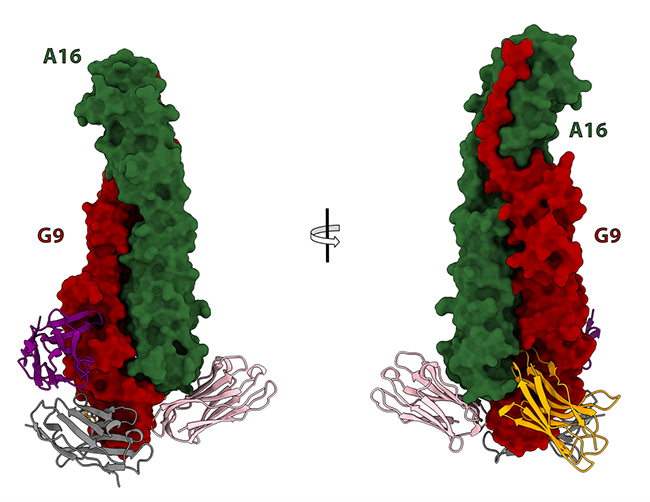
Pour comprendre comment ces anticorps bloquent l’entrée virale, ils les ont cristallisés avec A16/G9, ont collecté des données de diffraction X sur les lignes PROXIMA-1 et PROXIMA-2A, et ont obtenu des structures atomiques identifiant les sites de liaison des anticorps, ce qui a permis d’éclairer les mécanismes de neutralisation (Figure 2).
Enfin, ils ont immunisé des souris avec A16/G9 et montré que la réponse immunitaire induite protégeait les animaux contre une dose létale de poxvirus, indiquant que le complexe conçu peut être utilisé comme vaccin.
La prochaine étape consiste à évaluer si des vaccins contenant A16/G9 induisent de meilleures réponses immunitaires, ou des réponses plus durables, que les formulations vaccinales actuellement en essai clinique. À l’avenir, ils espèrent que ces travaux permettront de contenir les épidémies mortelles causées par le mpox ou tout autre poxvirus susceptible d’émerger ou de réémerger.
1 – zoonose : maladie ou infection dont l’agent pathogène (bactérie, virus, champignon, prion ou parasite) peut se transmettre des animaux aux humains, et inversement.