Un piège complexe: nouvelles thérapeutiques potentielles contre l'asthme et les allergies communes, ciblant le récepteur TSLP humain
La cytokine1 pro-inflammatoire TSLP (lymphopoïétine stromale thymique) joue un rôle essentiel dans les maladies allergiques largement répandues, notamment l'asthme et la dermatite atopique. Des données de diffraction des rayons X obtenues sur la ligne de lumière PROXIMA-2A par des chercheurs de l'Institut flamand de biotechnologie (VIB) et de l'Université de Gand en Belgique, ont permis de déterminer les structures 3D de la TSLP humaine en complexe avec son récepteur, mais aussi avec l'anticorps thérapeutique Tezepelumab, dont l'utilisation dans le traitement de l'asthme est en cours d'évaluation. Des études biophysiques et cellulaires complémentaires ont par ailleurs conduit à concevoir des antagonistes novateurs de la TSLP appelés « pièges à cytokine TSLP », qui inhibent fortement la TSLP in vitro et sont actuellement l’objet d’essais sur des modèles animaux.
La TSLP est un récepteur cellulaire de la famille des cytokines de l'interleukine-2 (IL-2) qui est activée dans les kératinocytes de la peau et les cellules épithéliales des poumons et de l'intestin, en réponse à des pathogènes. Elle régule la réponse immunitaire de ces ‘surfaces barrières’ en stimulant l'activation des cellules dendritiques immatures, des mastocytes, des basophiles, des éosinophiles et des lymphocytes.
Une activité aberrante de la TSLP a de graves conséquences sur la santé humaine et des répercussions sanitaires et socioéconomiques à très grande échelle. En fait, la TSLP est désormais largement considérée comme étant à l'origine des troubles allergiques inflammatoires les plus courants tels que les maladies atopiques (asthme, dermatite atopique et rhinite atopique), la bronchopneumopathie chronique obstructive (BPCO) et l'œsophagite à éosinophiles. La validité de la TSLP en tant que cible thérapeutique chez l'homme a été évaluée par un essai clinique dans lequel des patients asthmatiques ont été traités avec l'anticorps « Tezepelumab (AMG-157) » anti-TSLP, développé par Amgen et MedImmune.
Pour développer des stratégies thérapeutiques ciblant la TSLP, des équipes de l'Université de Gand et du VIB ont combiné études cristallographiques, biophysiques et cellulaires, dans le but de mieux comprendre les processus structurels et mécaniques liés à l'assemblage du complexe entre le TSLP et son récepteur –formé de 2 molécules différentes : TSLPR et IL-7Rα– qui est à l’origine de la signalisation pro-inflammatoire.
Structure 3D du complexe TSLP humaine/récepteur
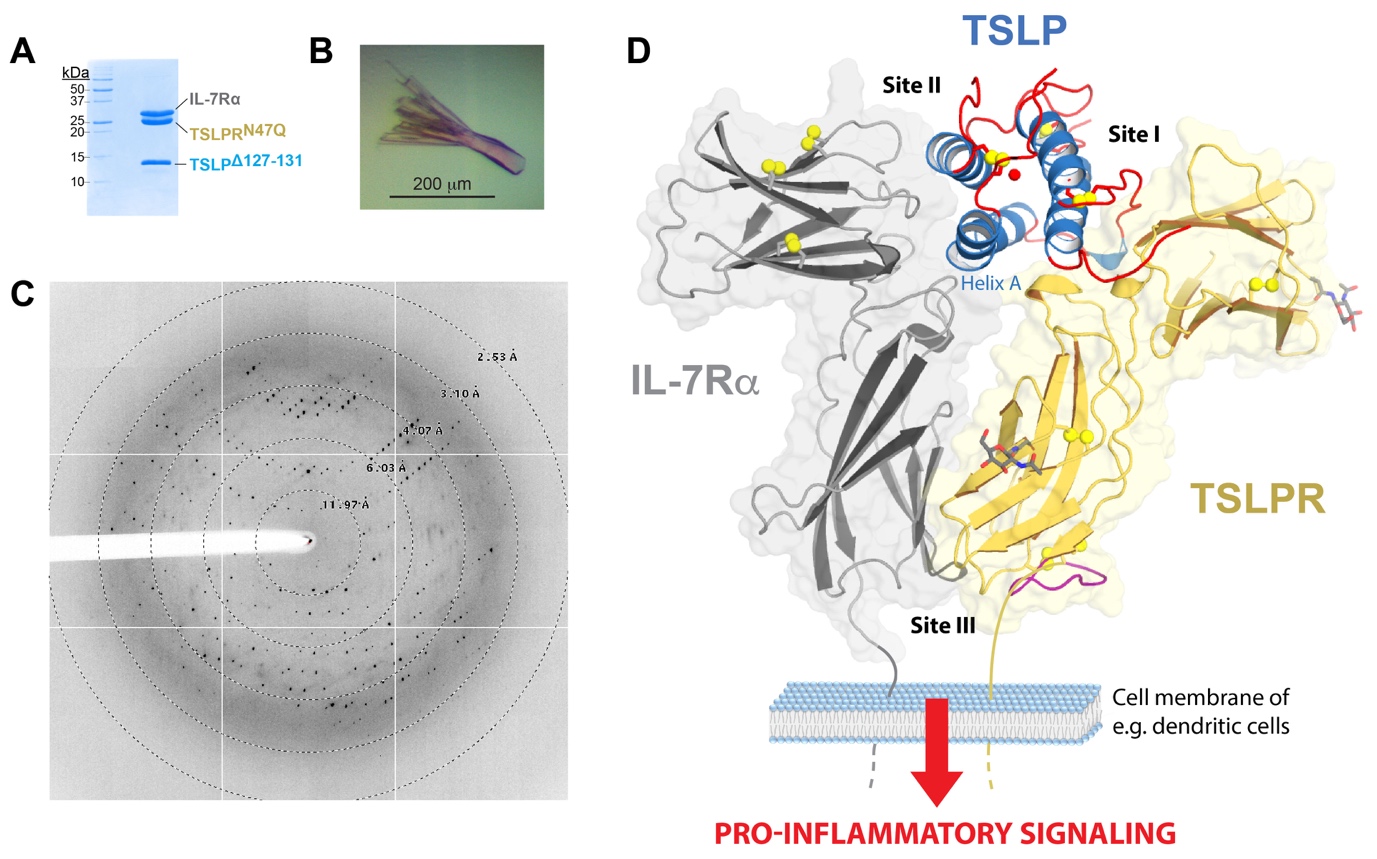
Des cristaux de haute qualité, générés à partir de protéines recombinantes produites par des bactéries et des cellules de mammifères (modifiées par glyco-ingénierie), ont été exposés au microfaisceau X de PROXIMA2-A. La résolution de diffraction de 2,55 Å (Figure 1A-C) a permis déterminer la structure du complexe TSLP humaine: TSLPR: IL-7Rα, à haute résolution.
La structure cristallographique déterminée (PDB 5J11; Figure 1D) révèle en détail comment la TSLP utilise deux zones opposées localisées à sa surface pour interagir avec les « coudes » des sites de liaison aux cytokines de TSLPR (site I) et IL-7Rα (site II). Ceci permet aux parties proximales des deux récepteurs d’interagir entre elles (site III).
Les données structurales (incluant des données RMN et des simulations de dynamique moléculaire), combinées à des études de liaison et à des tests in vivo, ont conduit les auteurs à proposer un mécanisme : l’assemblage débute par la formation d'un complexe transitoire TSLP:TSLPR à haute affinité, régie par l'attraction électrostatique à longue portée entre la TSLP et son récepteur à la surface de la cellule. Puis ont lieu deux événements structuraux concertés : (i) l'activation allostérique de la TSLP sur le site II, et (ii) le repositionnement du domaine proximal de la TSLPR, pour permettre les interactions avec le domaine extracellulaire correspondant de IL-7Rα au niveau du site III (Figure 1D).
Des pièges à TSLP
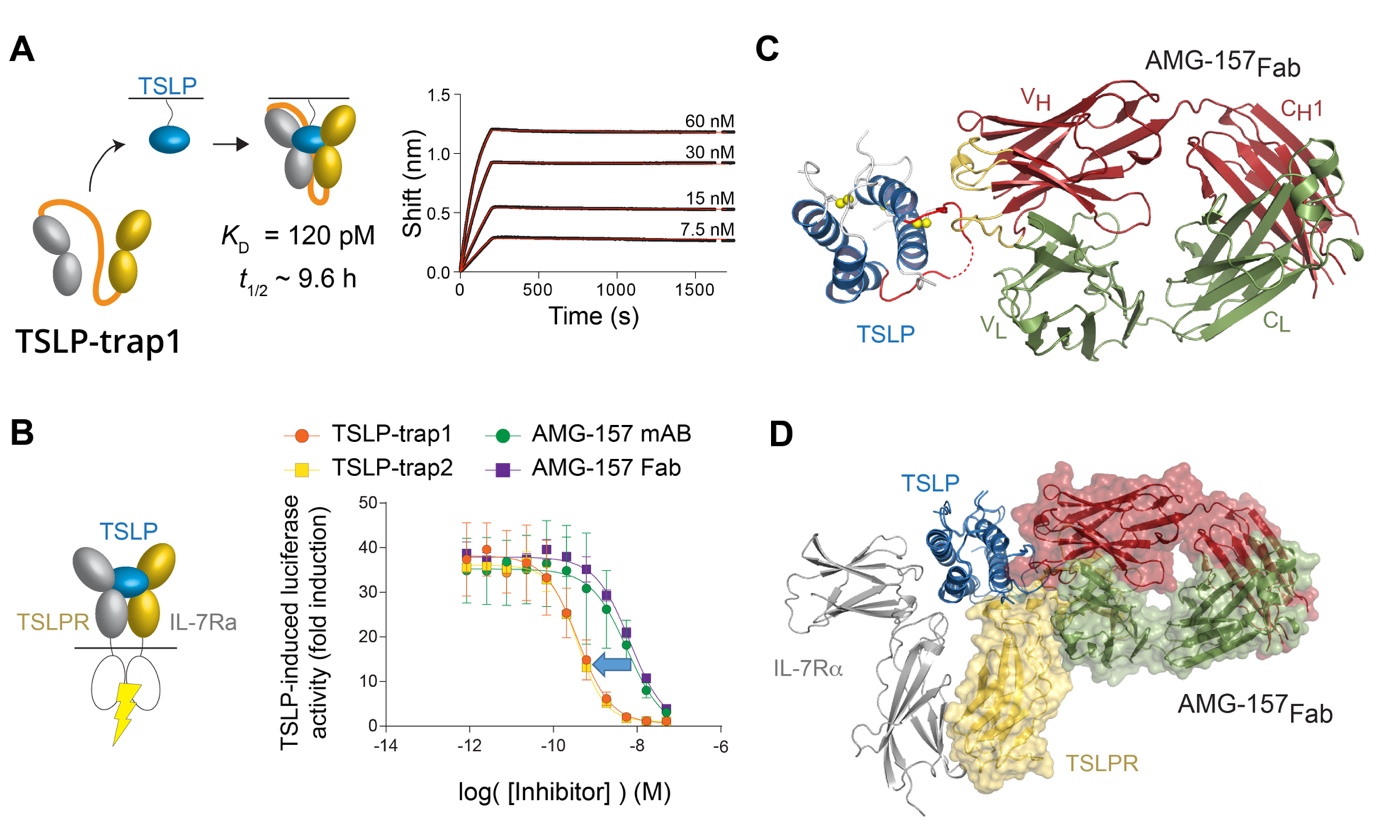
Les auteurs ont exploité la coopérativité intrinsèque du complexe TSLP:TSLPR:IL-7R pour développer des pièges à TSLP, de haute efficacité in-vitro, et ceci en liant les domaines extracellulaires de TSLPR et IL-7R afin de créer une protéine unique. Ces protéines-pièges de fusion neutralisent la TSLP en augmentant l'affinité de formation du complexe d'environ trois ordres de grandeur (KD = 120 pM) et en réduisant fortement la dissociation ou la cinétique de retrait (Figure 2A-B).
Les auteurs ont aussi saisi l'occasion d'obtenir des informations structurales et mécaniques sur la façon dont l'anticorps monoclonal Tezepelumab (AMG-157), qui est en cours d'évaluation pour le traitement de l'asthme, pourrait exercer son action antagoniste sur la TSLP. La structure résultante (PDB 5J13, Figure 2C) a révélé que cet anticorps empêche la formation du complexe TSLP:TSLPR:IL-7Rα en se fixant sur le site de liaison entre la TSLP et TSLPR (Figure 2D).
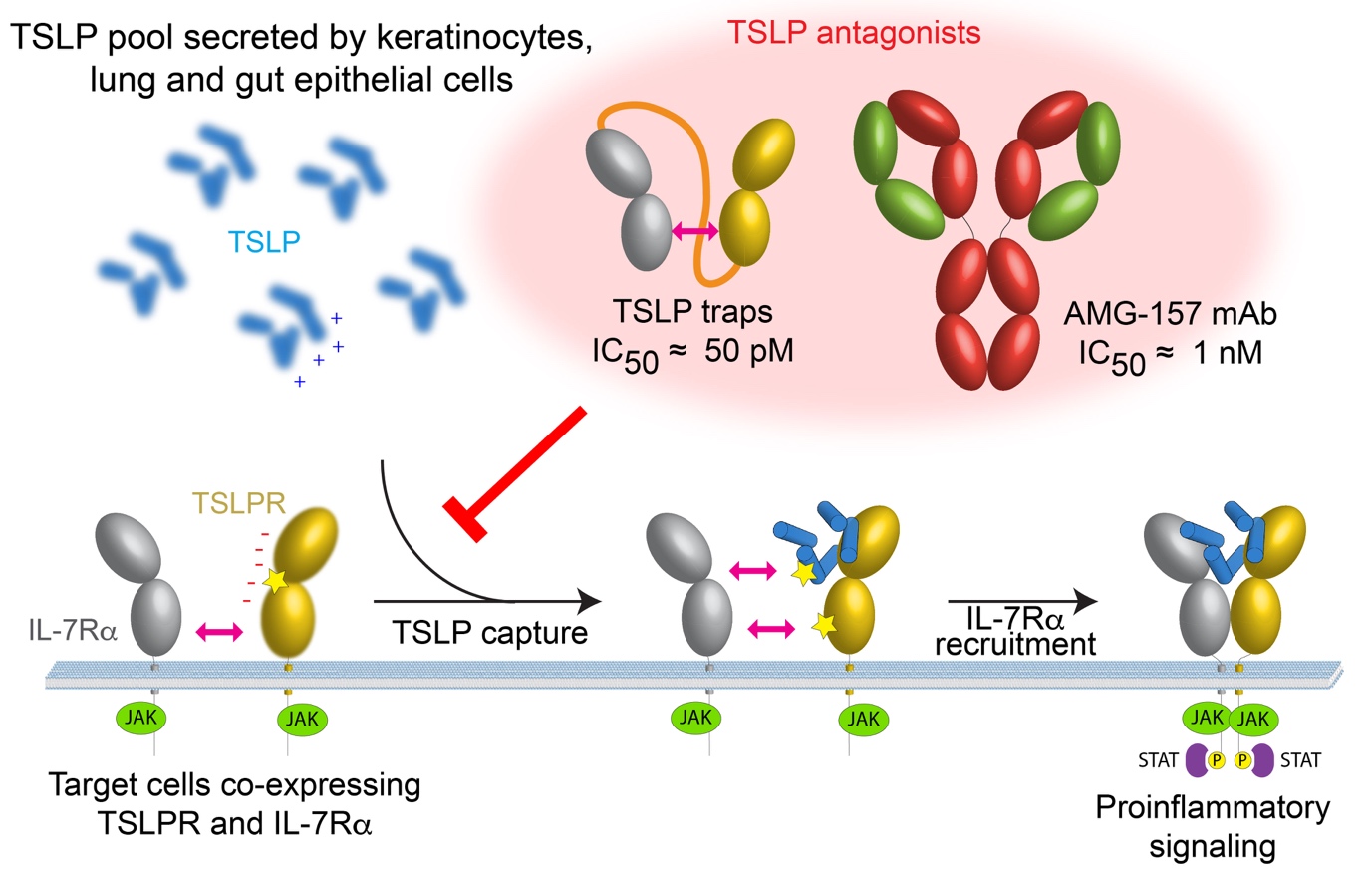
Le mécanisme proposé pour l'assemblage du complexe de signalisation de la TSLP, ainsi que des stratégies potentielles pour entraver cette signalisation pro-inflammatoire, sont récapitulées dans la Figure 3.
Les informations structurales et mécaniques, ainsi que les outils moléculaires, présentés dans cette étude faciliteront une compréhension plus approfondie de la signalisation par la TSLP in-vitro ainsi que dans des modèles animaux, et guideront les approches thérapeutiques qui manipulent la signalisation médiée par la TSLP pour traiter les maladies allergiques.
1 – cytokines : molécules (protéines ou glycoprotéines) de « communication cellulaire » - ex : interférons- produites par certaines cellules du système immunitaire pour réguler l’action d’autres cellules.