Un nouveau contexte pour l'histologie virtuelle : microimagerie RX en 3D du cerveau pendant son inclusion dans la paraffine
L'imagerie microscopique du cerveau réalisée pour identifier les maladies repose traditionnellement sur l'histologie : le tissu cérébral est enrobé dans de la paraffine et coupé finement pour être examiné au microscope. L'inconvénient de cette méthode est de ne fournir que des informations en deux dimensions (2D). De plus, la préparation des échantillons entraîne un rétrécissement non uniforme du tissu cérébral. Grâce à la microtomographie aux rayons X à contraste de phase et en trois dimensions (3D), une équipe interdisciplinaire de chercheurs a identifié ces distorsions et déterminé quelles méthodes de préparation sont les mieux adaptées pour obtenir des images radiographiques 3D à fort contraste du tissu cérébral.
L'histologie et l'histopathologie, c'est-à-dire la science de la structure des tissus et de la structure microscopique des tissus malades, sont les outils standard tant dans la pratique clinique - par exemple pour diagnostiquer le cancer - que dans la recherche médicale, y compris la neuro-imagerie. Ces méthodes reposent sur des coupes fines de tissus préparés spécifiquement pour être examinées au microscope. La préparation de ces échantillons implique une longue procédure de fixation chimique, de déshydratation, d'enrobage et, généralement, de coloration, qui modifie les propriétés chimiques et physiques du tissu échantillonné, y compris la forme et la taille des caractéristiques anatomiques. De plus, l'histologie conventionnelle ne donne que des images bidimensionnelles, généralement déformées en raison de la distorsion due au découpage. La microtomographie RX 3D à haute résolution a acquis le nom d'histologie virtuelle, car cette technique d'imagerie sans découpe physique permet de surmonter certaines limites de l'histologie traditionnelle.
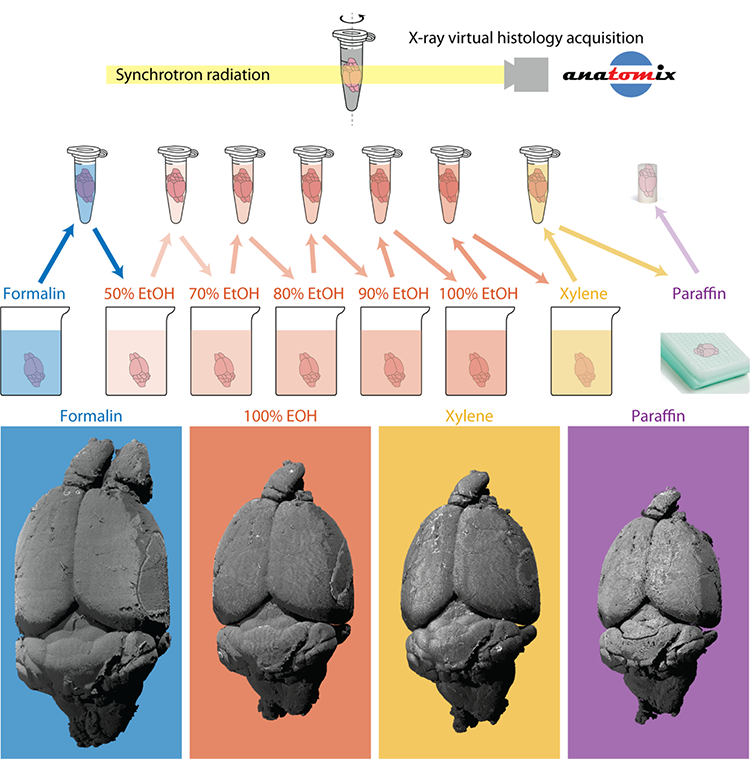
Une équipe interdisciplinaire suisse et française de chercheurs du Biomaterials Science Center de l'Université de Bâle et de l'Hôpital universitaire de Bâle, du groupe Interface de l'Institut de physiologie de l'Université de Zurich, du Pôle de recherche national suisse "Kidney.CH" et de SOLEIL vient de publier une étude dans laquelle un cerveau de souris complet a été imagé tout au long du protocole de préparation histopathologique standard, sur la ligne de lumière ANATOMIX de SOLEIL, et ce avec une taille de pixel de 3,1 µm. Grâce à l'analyse des jeux de données 3D, ils ont quantifié la composition et le rétrécissement du cerveau. Dans un premier temps, les structures anatomiques ont été marquées et les changements de volume correspondants ont été mesurés. Le rétrécissement n'étant pas uniforme, il a fallu déterminer la correspondance entre chaque point des différents ensembles de données 3D - une technique appelée « enregistrement ».
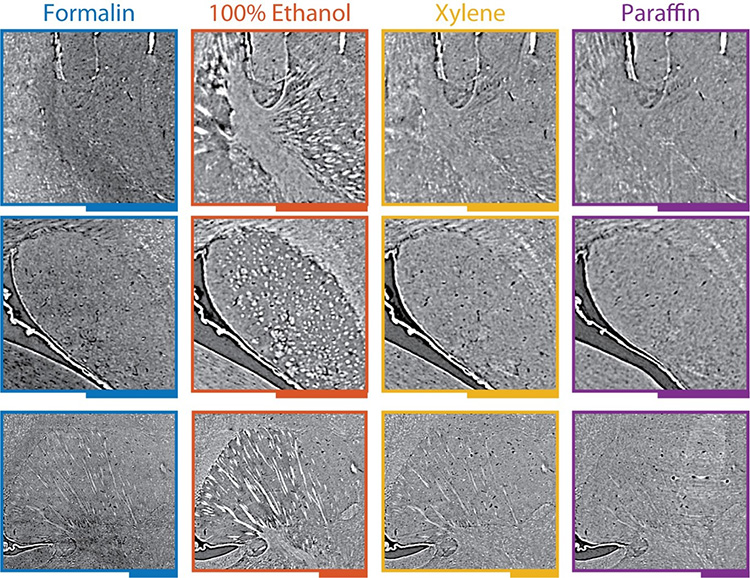
L'enregistrement a permis de calculer les champs de déformation volumétriques, qui sont des cartes 3D du rétrécissement du cerveau. Les scientifiques ont également transformé les ensembles de données de sorte qu'ils correspondent à l'état de fixation dans le formol, ce qui corrige efficacement la forme anatomique qui a été altérée pendant la préparation histologique. Un autre avantage de l'enregistrement est que l'anatomie peut être comparée en plaçant les images côte à côte pour révéler des changements parfois surprenants dans la densité des tissus - et donc dans le contraste et la qualité de l'image. Un changement remarquable a été une augmentation spectaculaire de la visibilité de faisceaux de fibres par la déshydratation à l'éthanol, un effet qui a été inversé par l'immersion dans le xylène et l'inclusion dans la paraffine.
Comprendre et corriger les effets de la préparation des tissus est essentiel pour l'histologie et l'histologie virtuelle. Cette nouvelle étude établit un cadre d'analyse de ce problème bien connu et permet aux chercheurs de tirer un meilleur parti de leurs ensembles de données d'histologie virtuelle. Par exemple, la connaissance des déformations dues au protocole d'enrobage permet aux chercheurs d'établir un lien plus précis entre l'imagerie à haute résolution de l'état post mortem et l'état in vivo. De plus, l'analyse des changements de densité des tissus permet de sélectionner le milieu optimal pour obtenir le meilleur contraste possible en imagerie RX et ainsi mettre en évidence les caractéristiques anatomiques d'intérêt. La présente étude était basée sur un cerveau de souris, mais la méthodologie fonctionne sur d'autres tissus mous tels que le rein, ainsi que sur des tissus durs comme les dents ou les os, qui sont généralement décalcifiés dans le cadre d'une analyse histopathologique.