Transmission du message nerveux. De nouvelles données structurales pour mieux comprendre l’action des benzodiazépines sur certains neurones
Les benzodiazépines comptent parmi les médicaments psychotropes les plus prescrits dans le monde pour traiter l’anxiété, l’insomnie, les convulsions, les spasmes... Ces molécules agissent en se fixant sur des sites spécifiques à l’extrémité de certains neurones et en modulant la transmission de l’influx nerveux. Afin de compléter les informations sur les mécanismes de régulation de cette transmission, un groupe de chercheurs européens a déterminé la structure 3D d’un récepteur neuronal lorsqu’il est lié à différentes molécules psychotropes. Ces résultats, publiés dans PNAS, sont en grande partie basés sur des données de diffraction obtenues sur la ligne PROXIMA 1.
L'acide γ-aminobutyrique, ou GABA, est le principal neurotransmetteur inhibiteur du système nerveux central chez l’Homme – et d’autres animaux. Cette molécule, sécrétée par certains neurones, intervient dans la régulation de l’activité neuronale : on parle de neuromodulateur ; la dopamine, la sérotonine ou le glutamate sont d’autres exemples de neuromodulateurs. L’effet inhibiteur du GABA contrebalance notamment les effets excitateurs du glutamate.
L’action du GABA est déclenchée par sa fixation à des récepteurs, présents aux extrémités des neurones. Il existe deux familles de récepteurs au GABA : les récepteurs GABAA et GABAB.
Les récepteurs GABAA sont membres de la famille dite des « pLGIC » : « canaux ioniques pentamériques (5 sous-unités) sensibles à un ligand », qui sont impliqués dans la transmission de l'inhibition de l’influx nerveux. A cette famille appartiennent également les récepteurs à la glycine, les récepteurs nicotiniques de l’acétylcholine ou les récepteurs 5-HT3 activés par la sérotonine. Dans ce type de canal, les 5 sous-unités sont disposées autour d’un pore central, et lorsque le ligand (GABA, glycine, ou autre) se fixe à son site de liaison, le pore s’ouvre, laissant passer des anions à l’intérieur du neurone. Dans le cas des récepteurs GABAA, la liaison du GABA provoque l'ouverture du canal et l'afflux d'ions chlorure Cl- dans le neurone, ce qui a pour conséquence l’hyperpolarisation du neurone et son inhibition : le message nerveux n’est plus transmis.
Récepteurs GABAA – mode d’emploi
Ces récepteurs GABAA ont donc des sites de liaison avec le GABA, mais aussi avec les benzodiazépines1 et d’autres molécules régulatrices, dont la fixation entraine un changement de la conformation des différentes sous-unités du récepteur. Ce changement de conformation a pour effet de modifier le site de liaison GABA/récepteur ce qui, dans le cas des benzodiazépines, augmente l’affinité GABA/récepteur : la fréquence et la durée de l’ouverture du canal Cl- augmentent, d’où une plus forte inhibition de l’influx nerveux.
Malgré des études poussées des récepteurs GABAA, et en particulier des sites de liaison du GABA et des benzodiazépines, il manque encore des données structurales aux rayons X sur les récepteurs GABAA des eucaryotes. Par contre, on connaît les structures 3D de plusieurs canaux de la famille ‘pLGIC’ à laquelle appartiennent les récepteurs GABAA : ‘ELIC’ et ‘GLIC’, deux canaux bactériens, ainsi que le canal au chlorure glutamate-dépendant (GluCl) d’un eucaryote (un ver, C. elegans). Ces données ont révélé l'architecture moléculaire d'états ouverts et fermés du récepteur, et les déterminants de la liaison avec le ligand.
ELIC et GABAA : points communs
Les auteurs des résultats publiés dans PNAS ont cherché à savoir si ces canaux aux structures 3D déjà connues interagissaient avec les mêmes molécules que celles qui se fixent sur les récepteurs GABAA des eucaryotes. Par criblage électrophysiologique à haut débit d’une banque de composés (acides aminés, intermédiaires de photosynthèse, neurotransmetteurs, agonistes et modulateurs de canaux ioniques sensibles à un ligand), ils ont découvert que le canal ionique ELIC était activé par GABA et pouvait être modulé par des benzodiazépines, avec des effets semblables aux récepteurs GABAA eucaryotes. Devant ces similitudes de « comportement », les chercheurs ont utilisé ELIC pour de nouvelles études structurales.
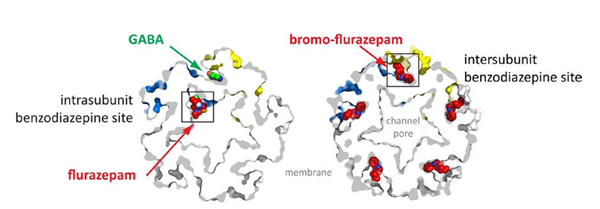
La structure aux rayons X de ELIC en complexe avec le GABA et des benzodiazépines a été obtenue grâce à des données de diffraction X obtenues sur PROXIMA1 et au SLS. Elle révèle que le GABA se lie dans le domaine extracellulaire à l'interface de la sous-unité, où il reste piégé par des résidus aromatiques, à la manière des interactions agonistes observées dans les protéines de liaison à l'acétylcholine et le canal GluCl.
Les chercheurs ont ainsi observé que les benzodiazépines pouvaient occuper deux sites de liaison différents dans ELIC en fonction de leur concentration. Le site de liaison intra-sous-unité est situé dans une poche localisée à l'opposé du site de liaison GABA, en face du vestibule du canal, ce qui correspond potentiellement à un site de liaison de faible affinité de la benzodiazépine aux récepteurs GABAA. Le site localisé entre les sous-unités est occupé par un analogue du flurazépam1, ou par le zopiclone1 (les données avec le zopiclone ont été obtenues à SLS) et ressemble au site de liaison à haute affinité des récepteurs GABAA.
Ces résultats présentent une vue structurale de la manière dont le GABA et les molécules modulatrices sont reconnus sur différents sites de liaison d'un canal de type pLGIC, ce qui constitue apporte de nouveaux éléments permettant de mieux comprendre l'activation et la modulation dans cette famille de canaux ioniques.
1- Les benzodiazépines sont une classe de composés chimiques, employés comme médicaments psychotropes agissant sur les neurotransmetteurs des neurones du système nerveux central en augmentant leur activité inhibitrice. Le Valium est historiquement le premier médicament de cette famille à avoir été utilisé. Le flurazépam fait aussi partie des benzodiazépines.
Le zopiclone est une molécule à effet hypnotique apparentée aux benzodiazépines, mais qui n’en fait pas partie.