Translocation des médicaments à travers la membrane des bactéries : nouveaux concepts pour définir l'activité antibiotique
Un challenge majeur en chimiothérapie est de déterminer les paramètres in cellulo qui contrôlent la concentration de médicament requise pour l'action thérapeutique. Une méthode combinant spectrofluorimétrie et microscopie a été développée par l’équipe « Transporteurs Membranaires, Chimiorésistance et Drug-Design » (Faculté de Médecine et Pharmacie, Aix-Marseille Université) en collaboration avec la ligne DISCO, pour mesurer l'accumulation d’antibiotique chez des bactéries Enterobacteriaceae. Récemment, l'optimisation de la méthode a permis d’étendre l'analyse aux bactéries isolées.
Chez les bactéries dites à Gram négatif, comprendre la diffusion de l'antibiotique à travers les membranes de la bactérie est une étape clé: l'antibiotique (ATB) doit franchir cette barrière membranaire afin d'atteindre, dans la bactérie, la concentration qui inhibera l'activité/fonction de la cible. Des méthodes innovantes et performantes sont nécessaires afin de quantifier et localiser la concentration intracellulaire en ATB. Elles permettront de corréler l'efficacité de pénétration et l'accumulation de l'ATB chez les souches de bactéries qui y sont sensibles ou résistantes et, ainsi, d'identifier comment certains pharmacophores (1) peuvent affecter l'entrée ou la durée de vie de la molécule d’ATB dans la bactérie.
Une méthode combinant spectrofluorimétrie et microscopie, basée sur des standards internes et des calibrations adéquates, a été développée par les chercheurs de l’équipe « Transporteurs Membranaires, Chimiorésistance et Drug-Design » sur la ligne DISCO pour mesurer l'accumulation d’ATB de la classe des fluoroquinolones chez des Enterobacteriaceae. Récemment, l'optimisation de la méthode a permis d’étendre l'analyse aux bactéries isolées.
Suivre et mesurer les antibiotiques dans les bactéries
Pour évaluer les « mouvements » d’ATB dans les bactéries, plusieurs paramètres liés à la pénétration (influx) et l’expulsion (efflux) du médicament par la bactérie doivent être pris en compte. La concentration interne en ATB (Cin) et sa concentration critique inhibitrice (Cinh) dépendent notamment des porines et les pompes d’efflux, protéines de la membrane bactérienne –canaux ou transporteurs « actifs »– impliquées dans le passage de molécules au travers de cette membrane. De plus, pour une classe d’ATBs donnée, la présence de pharmacophores spécifiques peut aussi avoir un impact.
La mesure de Cin et Cinh, pour un ATB sélectionné dans une bactérie donnée, participe à la définition du concept de "temps de résidence d'une concentration au voisinage de la cible" (RTC2T). Le RTC2T permet d'évaluer l'activité de différents adjuvants sur les concentrations d'ATBs spécifiques dans des bactéries exprimant des mécanismes de résistance associés à la membrane (influx diminué, efflux augmenté).
Un autre concept original : la "relation concentration intracellulaire-structure et activité", SICAR, contribue à définir le profil de l'ATB. Il a pu être élaboré par les scientifiques grâce à l'analyse en temps réel de l'accumulation d’un ATB après sa diffusion à travers les membranes bactériennes.
Etude de (deux) cas
La diffusion à travers les membranes bactériennes via les porines et pompes d'efflux a été étudiée pour des ATBs de différentes classes (ß-lactames ou fluoroquinolones). Cette diffusion est rapide, et le plateau de concentration est observé après des temps courts d'incubation. L'analyse en temps réel de l'accumulation de fluoroquinolones a précédemment montré différents profils cinétiques et le plateau d'accumulation dépend des propriétés chimiques et structurales des molécules d’ATB dans un contexte bactérien sélectionné. C’est à partir de ces résultats que le SICAR, "relation concentration intracellulaire-structure et activité", a été défini. Ce concept associe les propriétés physicochimiques de la molécule d’ATB à son efficacité de diffusion à travers la membrane et à son niveau d'accumulation dans la bactérie.
Ces paramètres ont été utilisés afin d'identifier le rôle de pharmacophores impliqués dans l'influx ou l'efflux, ainsi que pour définir une pharmacomodulation basée sur les interactions antibiotique-transporteurs membranaires. Deux cas ont été récemment étudiés:
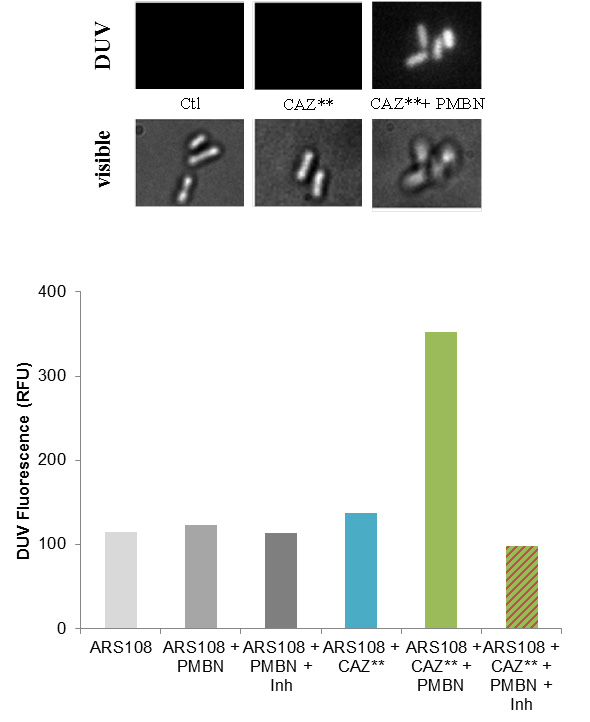
1- La ceftazidime (CAZ), une ß-lactame (céphalosporine) de 3ème génération, est utilisée en combinaison avec les inhibiteurs de ß-lactamases(2) dans le traitement des bactéries résistantes. Plusieurs CAZ fluorescentes ont été synthétisées afin de suivre les étapes précoces de translocation à travers la membrane externe, en mesurant la concentration interne et l'activité chez des souches bactériennes résistantes. La microspectrofluorimétrie et l'épifluorimétrie montrent la pénétration de la CAZ fluorescente dans le périplasme quand la membrane externe est perméabilisée (Figure 1). L'étude met en évidence la corrélation entre la concentration périplasmique et l'activité ATB en fonction de la perméabilité membranaire.
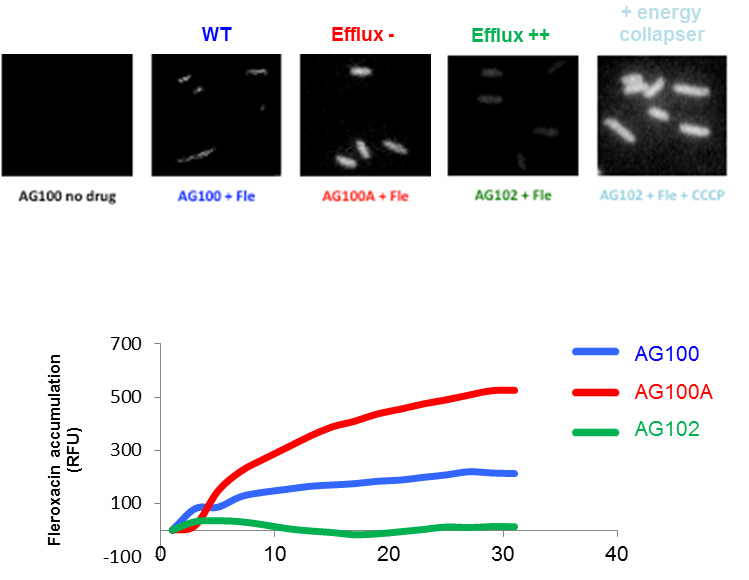
2- L'accumulation de fluoroquinolone a été analysée dans la population bactérienne et en cellule unique chez des souches bactériennes exprimant différentes quantités de pompes d'efflux (Figure 2). Les index SICARIN, correspondant à la concentration atteinte pendant les temps précoces d'incubation et SICAREF, rapport des accumulations mesurées en absence et en présence d'efflux, ont été obtenus. Le premier définit la relation structure-capacité de pénétration, et le second la relation structure-sensibilité à l'efflux.
Ces index RTC2T-SICAR pourront être utilisés afin de déterminer et d'améliorer les chemotypes d'ATB qui sont associés à la pénétration et/ou à la stabilité d'accumulation des ATB dans différentes espèces bactériennes.
La recherche ayant donné ces résultats a été conduite dans le cadre du projet TRANSLOCATION porté par l’organisme Innovative Medicines Initiative (IMI), convention de subvention n°115525 financée par le 7è programme de l’Union Européenne FP7/2007-2013 et la Fédération européenne des industries et associations pharmaceutiques (EFPIA). Ces recherches ont également été soutenues par l’Université d’Aix-Marseille, le Service de Santé des Armées, et les programmes de SOLEIL.
(1) pharmacophore : partie d’une molécule (ici : de l’antibiotique) déterminante pour l'activité de cette molécule.
(2) ß-lactamases : famille d'enzymes bactériennes à l’origine de la résistance des bactéries vis-à-vis des ATB de la classe des ß-lactames