Thérapie photodynamique profonde : une nanolampe de poche pour rendre actifs les médicaments dans les tumeurs solides
L’utilisation de la lumière pour traiter certaines pathologies n’est pas nouvelle, mais jusqu’à présent, les chercheurs se heurtaient à une limite majeure : la possibilité de ne traiter que des zones accessibles (peau, œsophage, poumons, …). Des scientifiques du synchrotron SOLEIL et du Centre de Biophysique Moléculaires d’Orléans ont mis au point une méthode de photochimiothérapie utilisant de manière ingénieuse des structures micellaires à base de lanthanide, et qui vient résoudre ce problème. Leurs travaux ont été publiés dans la revue Nano Research, et offrent de nombreuses perspectives y compris en imagerie par résonance magnétique.
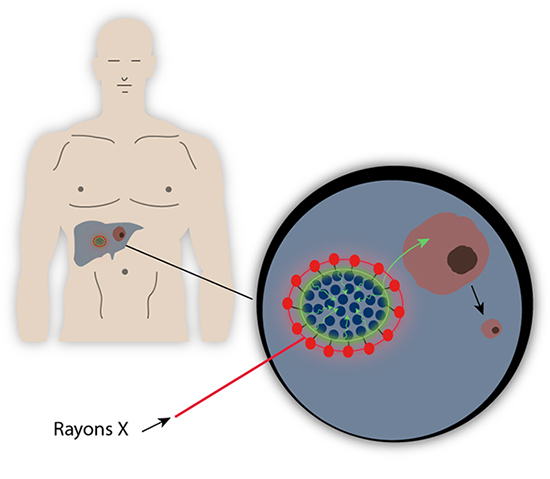
Afin de traiter certaines tumeurs, la lumière peut s’avérer extrêmement efficace notamment en thérapie photodynamique. Cette méthode s’appuie sur l’utilisation de substances qui deviennent toxiques pour leur environnement local lorsqu’elles sont soumises à une illumination visible. Tout l’enjeu revient donc à vectoriser ces substances dans la tumeur avant de les illuminer pour déclencher la réaction.
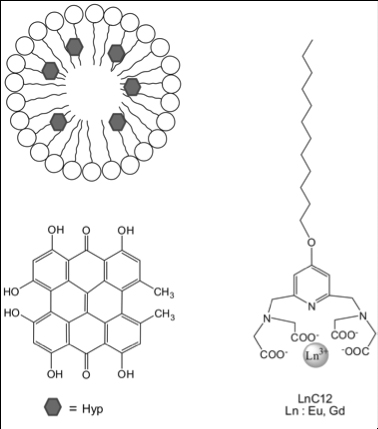
Les chercheurs ont eu l’idée de proposer une réaction en chaîne afin de permettre d’accéder à des tumeurs en profondeur. D’abord, une structure micellaire de liponanoparticules avec des lanthanides en périphérie vient entourer un photosensibilisateur, l’hypericine, ce qui permet de vectoriser cette substance hautement hydrophobe jusqu’à la zone à traiter. Puis l’ensemble est irradié par des rayons X qui vont initier la réaction en chaîne. En fait, les lanthanides ont une propriété de luminescence connue de longue date et ont par exemple enrichi les systèmes de détection des rayons X dans les années 90. Lorsqu’ils sont soumis à des rayons X, les lanthanides comme le Gadolinium ou l’Europium vont réémettre dans l’ultra-violet ou le visible. Cette source secondaire de lumière va alors irradier l’hypericine centrale qui va produire des dérivés réactifs de l’oxygène (ROS en anglais), substances toxiques qui vont tuer les cellules tumorales alentours.
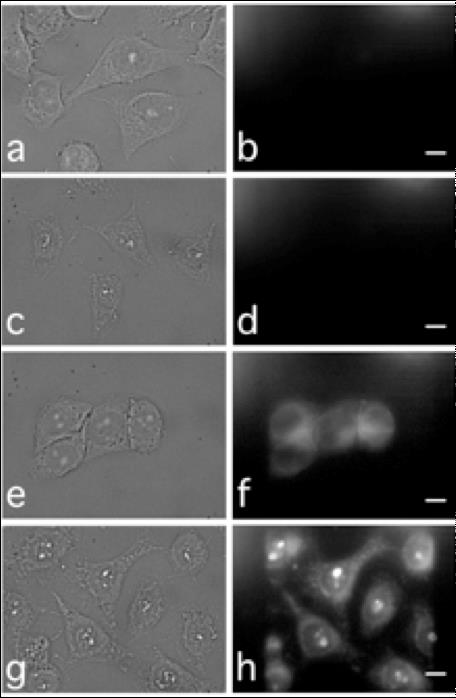
En pratique, les chercheurs ont utilisé les lignes de lumières METROLOGIE et DISCO de SOLEIL afin d’irradier des liponanoparticules, et de collecter les spectres de luminescence associés. Ils ont ainsi montré que la présence de lanthanides permettait bien d’émettre un rayonnement UV- visible, qui correspond au spectre d’absorption de l’hypericine. Ils ont ensuite caractérisé le transfert d’énergie lumineuse entre ces deux molécules. Puis ils ont pu mesurer par spectrométrie de masse l’augmentation de production de dérivés réactifs de l’oxygène suite à l’absorption de lumière par l’hypericine. Par ailleurs, les propriétés de luminescence dans l’UV de la structure micellaire ont permis aux scientifiques de les suivre à l’intérieur des cellules, et notamment à l’intérieur des noyaux.
Le système proposé ici a l’avantage d’être extrêmement versatile : il est en effet possible d’élargir cette méthode à d’autres photosensibilisateurs, ou d’autres liponanoparticules déjà adaptées à des cibles précises. Alors que les traitements photodynamiques actuels se cantonnaient à des thérapies superficielles, l’utilisation du pouvoir pénétrant des rayons X promet l’ouverture de nouvelles perspectives pour traiter les tumeurs profondes.