Signalisation cellulaire - Structure et fonction du domaine C-terminal d'un canal sodique tensiodépendant
Les canaux sodiques tensiodépendants sont des protéines complexes présentes dans les membranes de tous les organismes supérieurs, responsables du de l’entrée et de la sortie des ions Sodium à travers les cellules. Chez les humains, les mutations des canaux sodiques provoquent différentes maladies neurologiques et cardiaques, et sont associées au vieillissement et à la douleur.
Des équipes britanniques et américaines ont déterminé, notamment grâce à des expériences de diffraction X sur la ligne PROXIMA1, la structure 3D complète du canal sodique d’une bactérie, modèle pour ce type de protéine. A partir de ces résultats, publiés dans Nature Communications, les chercheurs proposent un nouveau mécanisme de fonctionnement pour ces canaux sodiques.
Les canaux sodiques tensiodépendants jouent un rôle essentiel dans la signalisation entre cellules car la première étape du potentiel d'action dans les cellules excitables implique l'ouverture du canal sodique. Chez les humains, les mutations du canal sodique donnent lieu à différentes maladies neurologiques et cardiaques, et sont associées au vieillissement et à la douleur; par conséquent, ces canaux sont la cible de nombreux médicaments, y compris ceux qui traitent l'épilepsie, la douleur chronique et les maladies cardiovasculaires. Du fait que des canaux sodiques similaires sont présents chez les insectes, ils sont également la cible d'insecticides importants pour l'agriculture (y compris les pyréthrinoïdes); il est pourtant essentiel que les insecticides puissent distinguer entres les canaux des humains et ceux des insectes.
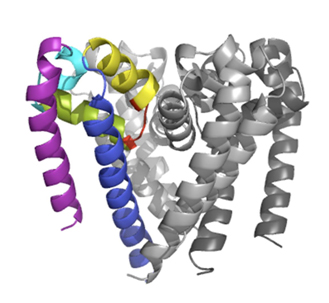
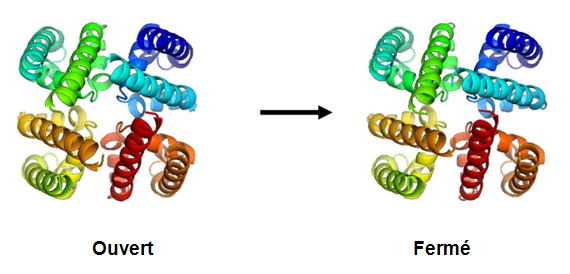
Les canaux sodiques sont aussi présents dans certaines bactéries, mais chez celles-ci ces canaux sont légèrement plus simples (quoique ayant des séquences et caractéristiques homologues des canaux eukaryotes); ils sont donc parfaits pour étudier la structure et le fonctionnement des ces protéines. Les canaux ioniques des bactéries sont des tétramères composées de domaines transmembranaires sensibles aux variations de potentiel et domaines pore, et d'un domaine cytoplasmique, à l’extrémité C-terminale de la protéine (CTD). La première structure cristalline d'un pore de canal sodique à l'état ouvert a été résolue (McCusker et al, 2012) en utilisant des données recueillies sur la ligne PROXIMA1 à SOLEIL.
Cette structure permet de comprendre comment les canaux s'ouvrent et se ferment : par la rotation d'une seule liaison au milieu de l'hélice S6.
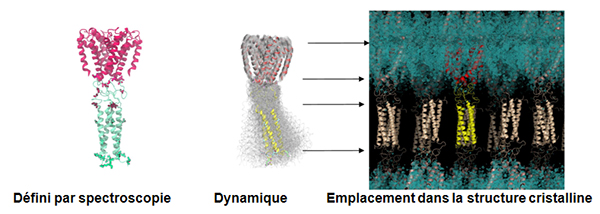
Récemment, la structure du canal a également été résolue en mettant en évidence l'emplacement, la structure et la fonction de ce domaine C-terminal (Bagnéris et al, 2013) en utilisant des données collectées sur PROXIMA1. Jusqu’alors, toutes les structures cristallines précédentes des canaux sodiques des bactéries dévoilaient la nature de leurs domaines transmembranaires, mais pas des CTD. Deux méthodes spectroscopiques ont été employées: la résonance paramagnétique électronique combinée à la dynamique moléculaire afin de déterminer sa structure quaternaire, et des études par dichroïsme circulaire en rayonnement synchrotron (SRCD) pour déterminer sa structure secondaire (en utilisant des données recueillies sur la ligne de lumière DISCO à SOLEIL – (Powl et al, 2010)), afin de montrer que le domaine C-terminal du canal NavMs de la bactérie Magnetococcus marinus inclut une région flexible liant les domaines transmembranaires à un faisceau à quatre hélices. Cette nouvelle structure cristalline (à une résolution de 2.9 Å) du pore NavMs montre la position du domaine CTD, en accord avec les structures déduites de la spectroscopie.
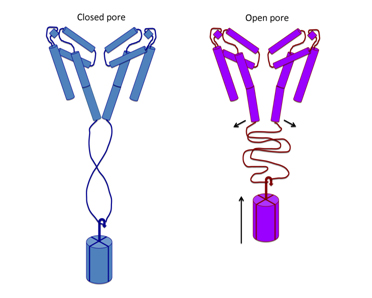
Les études électro-physiologiques du fonctionnement des canaux ioniques démontrent que le domaine super hélice est important pour la stabilité d'un canal et que la région de connexion flexible couple inactivation et ouverture du canal, et que les résidus de charge négative de la région de connexion sont essentiels pour sa fonction. Un nouveau mécanisme de gating (ouverture/fermeture) est proposé à partir de cette structure, dans lequel l'écartement du fond du pore est possible sans défaire la superhélice.
Références:
McCusker, E.C., Bagnéris, C., Naylor, C.E., Cole, A.R., D’Avanzo, N., Nichols, C.G., and Wallace, B.A. (2012) Structure of a bacterial voltage-gated sodium channel pore reveals mechanisms of opening and closing. Nature Communications 3:1102.
Powl, A.M., O’Reilly, A.O., Miles, A.J. and Wallace, B.A. (2010) Synchrotron radiation circular dichroism spectroscopy-defined structure of the C-terminal domain of NaChBac and its role in channel assembly. Proc. Natl. Acad. Sci. USA, 107:14064-14069.