Quelle protéine est responsable de l'accumulation d'uranium dans le squelette ?
Des radiochimistes du CNRS/Université Paris-Sud à Orsay (IPNO) et du CNRS/Université de Nice-Sophia Antipolis (ICN), et des biologistes de la division sciences de la vie du CEA (DSV), ont collaboré avec la ligne de lumière MARS et ont réussi à répondre à cette question fondamentale.
Le développement considérable de l'industrie nucléaire pour les applications civiles et militaires au siècle dernier a augmenté les risques liés à la diffusion des radionucléides ou aux expositions à ceux-ci. Dans ce contexte, les études toxicologiques sur l'impact des radionucléides, et en particulier de l'uranium, sont d'une importance cruciale.
Des études médicales au sujet de la toxicité de l'uranium ont montré que la plupart des patients exposés à cet élément avaient développé une insuffisance rénale ou un cancer des os. Pour ce dernier cas, on conjecture qu'au niveau moléculaire, l'ostéopontine (OPN), une protéine cible humaine nouvellement identifiée, pourrait jouer un rôle important dans l'accumulation in vivo de l'uranium dans les régions de croissance osseuse, susceptible a posteriori d’induire un cancer des os. La description de l'interaction de l'OPN avec l'uranium sur le plan structural et thermodynamique a donc une grande importance pour obtenir davantage d'informations sur l'accumulation de l'uranium dans les os, ainsi que pour développer d'éventuelles méthodes de remédiation pour la contamination des os par l'uranium.
Couplage de techniques expérimentales et de calculs théoriques
Les études effectuées sur la séquence en acides aminés de l'OPN ont identifié un site actif (avec le nom de code H8V) qui joue un rôle majeur dans l'inhibition de la croissance de la matrice osseuse. Les protéines étant complexes par nature, l'étude a consisté à examiner l'interaction des ions uranium avec une molécule de 8 acides aminés (octapeptide) imitant ce site actif.
L'approche expérimentale utilisée combine la spectroscopie, en particulier l'EXAFS (Extended X-Ray Absorption Fine Structure) en rayonnement synchrotron, la thermodynamique et les calculs théoriques (DFT).
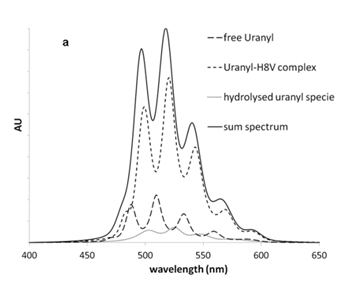
Initialement, les aspects thermodynamiques et la spéciation de l'interaction de l'uranium avec la molécule de peptide ont été étudiés en utilisant la spectroscopie laser de fluorescence résolue dans le temps (TRLFS) et la calorimétrie à titrage isotherme (ITC). Ces deux techniques ont révélé qu'un seul atome d'uranium, dans l'état d'oxydation VI, était fixé au site actif étudié avec une affinité chimique apparente assez forte (Log Ka = 3), ce qui confirme la supposition des chercheurs que l'uranium interagit avec l'OPN.
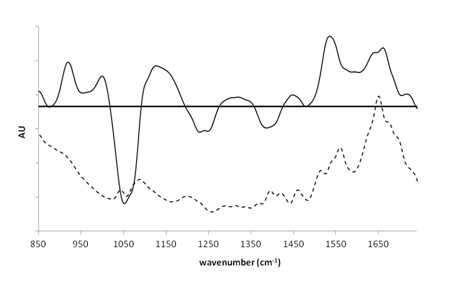
Ensuite, la spectroscopie infrarouge à transformée de Fourier en réflexion totale atténuée (ATR-FTIR) a été utilisée pour comprendre l'environnement moléculaire du complexe uranium(VI)-peptide afin de déterminer le mode de liaison du groupe carboxylate du peptide et de détecter l'interaction attendue avec le groupe phosphate de ce peptide. La présence sur le spectre différentiel (Fig1, droite) d'une bande négative à 1383 cm-1 et d'une bande positive à 1459 cm-1 est caractéristique d'un mode de liaison bidentate (2 liaisons) pour le carboxylate. D'autre part, la présence de bandes à 1246 cm-1, 1056 cm-1 et 1124 cm-1 est caractéristique d'un changement géométrique dans les groupes phosphates induit par la liaison de l'uranium.
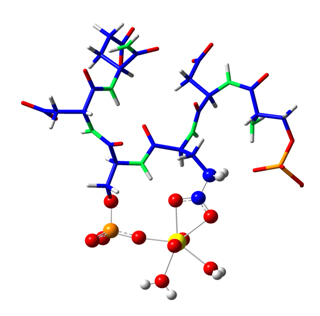
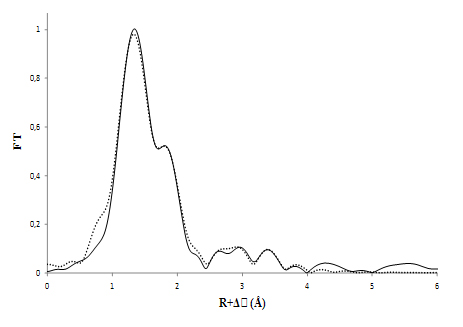
Enfin, des études structurales supplémentaires ont été effectuées pour sonder l'environnement de coordination de l'uranium en utilisant la spectroscopie EXAFS. Ces expériences ont été réalisées sur la ligne MARS, dédiée à l'étude des matériaux radioactifs. En parallèle, ont été testés divers modèles structuraux qui ont été développés en accord avec les précédentes données spectroscopiques et thermodynamiques, et optimisés par des calculs théoriques ab-initio. Il a été alors possible de faire un ajustement sur les données expérimentales EXAFS en utilisant la courbe correspondant à l'une des structures identifiées par la théorie.
Comment l’ostéopontine fixe l’uranium
La procédure d'ajustement EXAFS a indiqué que l'uranium était lié à un groupe fonctionnel phosphoryle et à un groupe fonctionnel carboxyle de la molécule de peptide, avec une distance moyenne de 2,90 Å entre l'atome d'uranium et celui de carbone, et de 3,87 Å entre l'atome d'uranium et celui de phosphore. Ces distances sont caractéristiques d'un complexe de sphère interne avec un atome d'oxygène partagé par l'uranium et le groupe phosphoryle, et deux atomes d'oxygène provenant d'un unique groupe carboxyle (mode de coordination bidentate). La sphère de coordination était complétée par deux molécules d'eau.
La pertinence de cette approche a aussi été confirmée par les mesures EXAFS effectuées sur la protéine entière. En effet, l'environnement de coordination observé avec le site actif de l'octapeptide était étonnamment semblable à celui qui se formait avec la protéine entière dans des conditions exactement identiques.
Cette étude a non seulement réussi à apporter un éclairage sur l'accumulation de l'uranium dans les os, mais aussi élargi le champ de recherche classique existant dans la littérature. En effet, la plupart des études sur l'uranium réalisées jusqu'à présent étaient consacrées à des sites de liaison protéine-métal déjà connus, ignorant ainsi toutes les séquences potentielles de sites de liaison non caractérisées dans les protéines. Dans leurs études à venir, les chercheurs espèrent identifier et caractériser de nouvelles protéines cibles de l'uranium afin de rationaliser les mécanismes intrinsèques de bioaccumulation qui régissent la toxicité de ce métal.