Première structure d’une protéine d'enveloppe du virus de la rubéole
Dans le cadre des recherches sur les protéines de fusion virales, les chercheurs de l’Unité de Virologie Structurale de l'Institut Pasteur, dirigée par Félix Rey, ont déterminé la première structure d'une protéine du virus de la rubéole. Il s’agit de la glycoprotéine d'enveloppe E1, responsable à la fois de la liaison du virus à un récepteur cellulaire et de la fusion membranaire du virus avec la cellule cible. La structure, résolue à 1.8 Å à partir de données collectées notamment sur la ligne PROXIMA 1, révèle l'ectodomaine de la protéine E1 dans sa forme post-fusion trimérique. Ces résultats sont publiés dans la revue Nature.
Le virus de la rubéole est l’agent responsable de cette maladie généralement bénigne touchant les enfants. Elle peut cependant provoquer de graves malformations congénitales lorsqu’une femme enceinte transmet le virus au fœtus in utero. Alors que l'utilisation du triple vaccin rougeole-oreillons-rubéole (ROR) a permis de protéger la population humaine dans les pays développés depuis 40 ans, le syndrome de rubéole congénitale reste un problème de santé publique majeur dans les pays en développement où la vaccination n'est pas systématique.
Le virus de la rubéole est le seul membre du genre des Rubivirus appartenant à la famille des Togaviridae, qui inclut aussi le genre Alphavirus dont le virus chikungunya fait partie. Malgré son importance médicale, l'organisation structurale du virus de la rubéole reste très peu connue à l'heure actuelle.
Structure
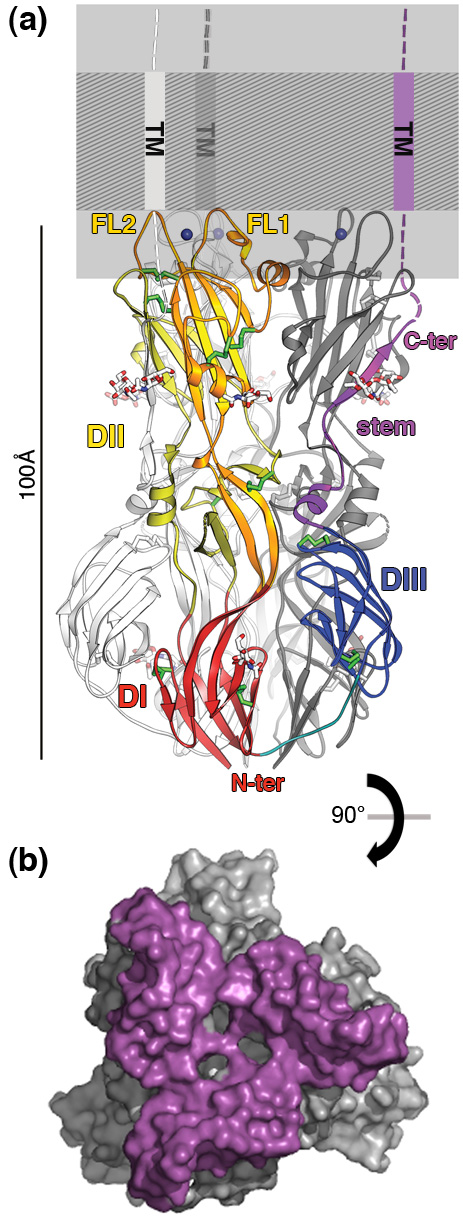
La glycoprotéine E1 est l'antigène principal et la seule cible des anticorps neutralisants contre le virus de la rubéole. Sa structure a permis de localiser un épitope reconnu par des anticorps neutralisants, permettant ainsi d’identifier le mécanisme de neutralisation. La protéine E1 est aussi impliquée dans l'entrée du virus dans les cellules cibles par sa liaison à un récepteur cellulaire de surface et en induisant la fusion membranaire. La structure du trimère de E1 révèle une surface d’interaction (ou surface de fusion) très importante avec la membrane, comprenant deux boucles ainsi qu'un site métallique par protomère (voir Figure). Il s’agit d’une caractéristique unique qui la différencie des protéines d'enveloppe de fusion membranaire des alphavirus et flavivirus. L'étendue de la surface de fusion suggère qu'elle pourrait induire une pression importante lors de l'insertion membranaire du virus, de façon à catalyser plus efficacement la fusion des membranes virale et cellulaire.
Les sites de fixation du métal observés dans le trimère de E1 peuvent être occupés par des ions sodium ou calcium, et les propriétés de liaison de E1 aux lipides sont différentes en fonction de la nature de cet ion et du pH.
La présence de métal dans E1 évoque les protéines cellulaires de la famille "T-cell immunoglobulin and mucin (TIM)" (2), lesquelles reconnaissent spécifiquement, via un métal, les têtes lipidiques des phosphatidylsérines à la surface plasmatique des cellules en apoptose (mort cellulaire programmée).
Evolution
La protéine E1 du virus de la rubéole est une protéine de fusion membranaire de classe II, classe qui englobait jusqu'à présent les protéines d'enveloppe des alphavirus (3) et flavivirus (4). Ces derniers virus ont pour vecteurs les arthropodes (moustiques, tiques, ...), au contraire des virus de la rubéole, de la rougeole et des oreillons, pour lesquels la transmission inter-humaine se fait par aérosols. Les comparaisons structurales montrent que les protéines correspondantes des alphavirus et des flavivirus sont structuralement plus proches entre elles qu'elles ne le sont de la protéine E1 du virus de la rubéole.
Cette observation suggère que les cycles répétés de transmission entre vertébrés et arthropodes imposent des contraintes qui conduisent à une évolution plus conservative pour leurs protéines de fusion. En l’absence de cette contrainte associée à la réplication du virus dans différents hôtes, le virus strictement humain de la rubéole aurait évolué vers une niche unique comme le seul membre du genre Rubivirus.
Références:
1. Wolinsky JS, Sukholutsky E, Moore WT, Lovett A, McCarthy M, Adame B. An antibody and synthetic peptide defined rubella virus E1 glycoprotein neutralization domain. J. Virol. 67, 961–968 (1993).
2. Santiago C, Ballesteros A, Martinez-Munoz L, Mellado M, Kaplan GG, Freeman GJ, Casasnovas JM. Structures of T cell immunoglobulin mucin receptors 1 and 2 reveal mechanisms for regulation of immune responses by the TIM receptor family. Immunity 26, 299–310 (2007).
3. Conformational change and protein-protein interactions of the fusion protein of Semliki Forest virus. Gibbons DL, Vaney MC, Roussel A, Vigouroux A, Reilly B, Lepault J, Kielian M, Rey FA. Nature 427, 320-325 (2004).
4. Structure of a flavivirus envelope glycoprotein in its low-pH-induced membrane fusion conformation. Bressanelli S, Stiasny K, Allison SL, Stura EA, Duquerroy S, Heinz FX, Rey FA. EMBO J. 23:728-738 (2004).