Perspectives pour trouver de nouveaux composés antipaludiques, grâce à la compréhension du fonctionnement de la protéine humaine hQR2
Face à la baisse récente d’efficacité des traitements antipaludiques, de nouvelles pistes sont explorées pour lutter contre la malaria. Des chercheurs de l’Université Toulouse 3, des Laboratoires Servier et de la société Vectalys ont étudié des molécules de synthèse (INODs), connues pour leur activité antipaludique mais dont le mécanisme d’action restait flou. La quinone réductase 2 (hQR2) est décrite comme étant une cible de traitements contre la malaria. Les structures 3D de complexes INODs/hQR2 ont été déterminées par diffraction des rayons X sur PROXIMA-1. Associées à d’autres expériences : cinétiques, RPE, les structures obtenues aident à comprendre pourquoi ces molécules sont efficaces dans les traitements existants.
Ces résultats, inattendus, ouvrent des perspectives de recherche inédites pour explorer une nouvelle classe de composés antipaludiques. Ils sont publiés dans la revue Molecules.
Le paludisme, ou malaria, est une infection potentiellement mortelle sévissant dans les zones tropicales et subtropicales. Cette maladie est transmise par la piqûre d'un moustique infecté par le parasite unicellulaire du genre Plasmodium. Depuis une vingtaine d’années, l'utilisation massive d'antipaludiques associée à celle de moustiquaires imprégnées d'insecticides ainsi que l'emploi de sprays répulsifs d'intérieur ont permis de réduire de 62 % les taux de mortalité par paludisme. La résistance à toutes les classes d'antipaludiques est toutefois responsable d'une hausse récente de la mortalité liée au paludisme et a souligné la nécessité d'identifier de nouveaux traitements.
Quand le parasite s’adapte aux traitements…
Quatre espèces de Plasmodium sont connues pour infecter l'homme mais l'une d'elles, Plasmodium falciparum, est responsable de plus de 400 000 décès chaque année. Au cours de la phase dite pré-érythrocytaire (ou hépatique) du cycle infectieux, le parasite entre dans la circulation sanguine et infecte les cellules du foie (hépatocytes). Si l'infection n'est pas traitée, le parasite va entamer sa phase de maturation et infecter les érythrocytes (globules rouges) au cours de la phase érythrocytaire, qui peut s’avérer mortelle.
Au cours de ces 5 dernières décennies, le traitement antipaludique de routine a consisté en des associations de schizontocides (c’est-à-dire de traitements ciblant le parasite devenu actif) de type quinoléine peu coûteux et largement accessibles comme la 8-aminoquinoléine (la primaquine) et la 4-aminoquinoléine (la chloroquine). Ces molécules agissent respectivement sur les phases pré-érythrocytaire et érythrocytaire de l'infection. Le déploiement massif de ces médicaments a toutefois entraîné l'apparition, en particulier chez P. falciparum, de souches résistantes responsables d'une résurgence du paludisme au niveau mondial. Par la suite, des combinaisons thérapeutiques à base d'artémisinine ont été mises en place au milieu des années 90 et ont permis de faire chuter sensiblement la mortalité due au paludisme. Des cas récents de résistance à l'artémisinine ont toutefois été documentés et il est devenu urgent de développer de nouvelles approches thérapeutiques rationnelles.
Comprendre le rôle de molécules déjà impliquées dans les traitements
La protéine humaine quinone réductase 2 (hQR2) catalyse la réduction biélectronique des substrats de type quinone. Des études exhaustives ont mis en lumière le fait que la QR2 est l'unique cible humaine des antipaludiques de type quinoléine. Par conséquent, de gros efforts ont été faits pour synthétiser de nouveaux inhibiteurs puissants de la QR2 en pensant que ces molécules seraient des agents antipaludiques très actifs. Malheureusement, aucun lien n'a pu être établi entre les propriétés inhibitrices et antipaludiques de ces nouvelles molécules.
Par ailleurs, les indolone-N-oxydes (INOD) sont des composés synthétiques présentant une activité antiplasmodiale durant la phase érythrocytaire de P. falciparum. On sait de plus que, parmi tous les INOD, seules les molécules contenant une structure pseudo-quinoïde et une liaison C=N réductible ont une activité antipaludique, tout comme les indolones obtenues à partir de la désoxygénation des INOD. Bien que le mécanisme de réduction des INOD doive être éclairci, les expériences publiées récemment dans la revue Molecules montrent que les substrats de QR2 pourraient avoir une activité antipaludique grâce à un mécanisme enzymatique insoupçonné jusqu’à ce jour.
Dans le cadre de ces recherches, des tests cinétiques ont été réalisés sur la hQR2 et les INOD ou les indolones. Ils indiquent que la QR2 les métabolise, bien que plus lentement que « la molécule référence » : la ménadione, substrat de l’enzyme. Pour la première fois, il est ainsi démontré que les molécules qui présentent une activité antiplasmodiale sont des substrats et non pas des inhibiteurs de la QR2.
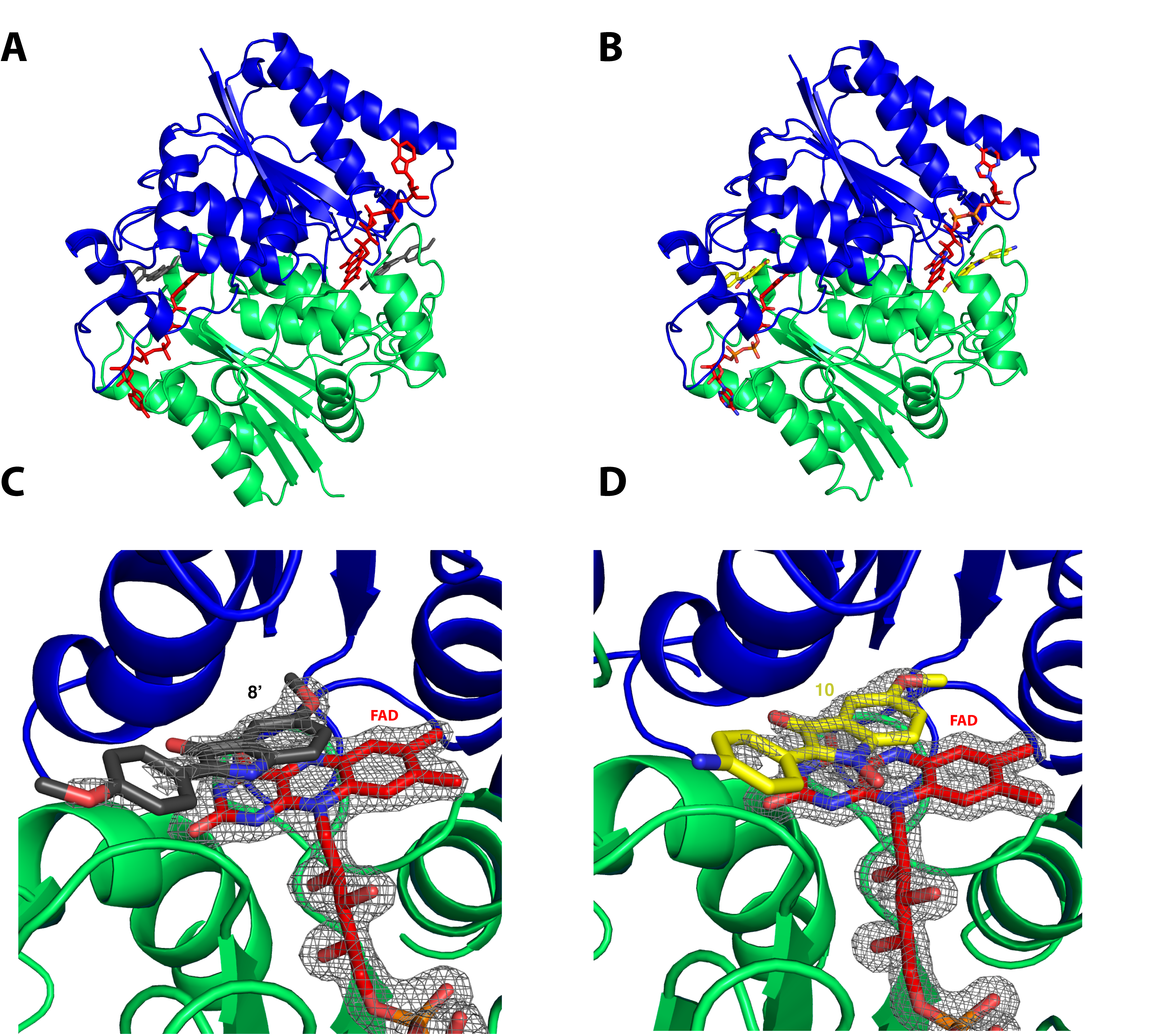
Les données de diffraction des rayons X recueillies sur la ligne PROXIMA-1 ont ensuite permis de déterminer la structure de la hQR2 complexée avec la coenzyme flavine adénine dinucléotide (QR2-FAD) et liée à un INOD et à un indolone choisis suite aux tests enzymatiques, à savoir les composés 8′ ou 10. Ces structures confirment la bonne reconnaissance des composés par la QR2, soulignant leur géométrie de liaison dans le site catalytique de la QR2 au-dessus du FAD, comme cela a pu être précédemment observé pour d'autres substrats et inhibiteurs de la hQR2. Les composés 8′ et 10 établissent des interactions attractives et non covalentes avec le cycle isoalloxazine du FAD sans interagir directement avec les résidus protéiques (Fig.1).
L’action antipaludique des INOD n’est pas celle que l’on croyait
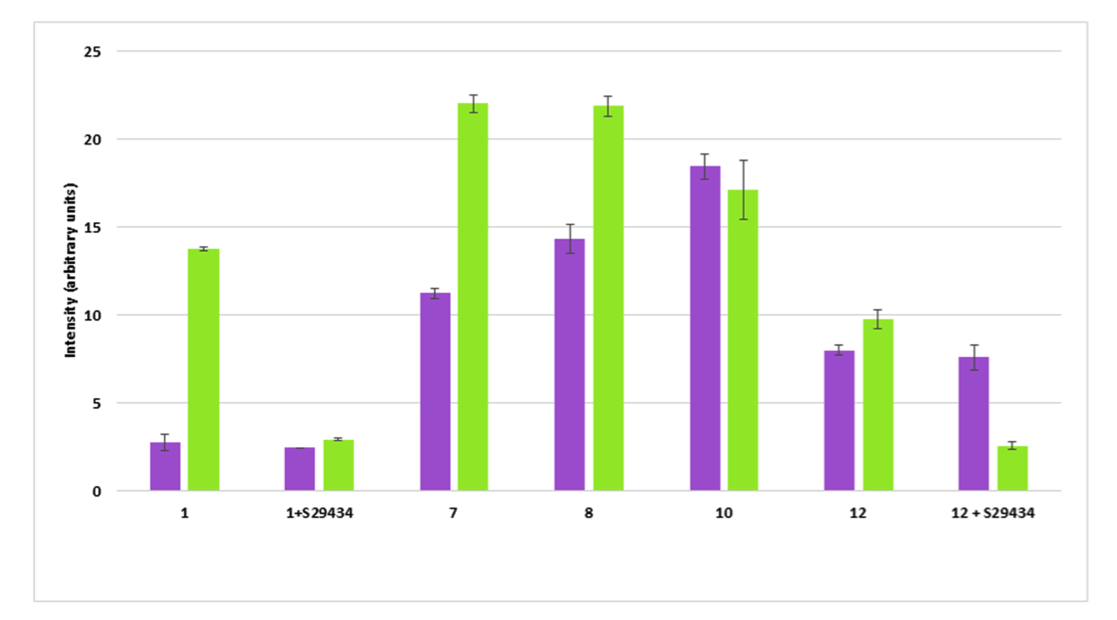
Les quinones sont connues pour générer des radicaux libres une fois réduites par la QR2. Dans cette étude, des mesures de RPE ont été effectuées sur les dérivés indolone afin de mettre en lumière de possibles formations de radicaux libres après réduction par la QR2. Il est intéressant de noter que ces dérivés réduits par la hQR2 produisent également des radicaux libres. Cependant, les dérivés d'indolone dépourvus de structure pseudo-quinoïde ne peuvent pas être métabolisés par la QR2 et ne présentent pas d'activité antipaludique, ce qui suggère un lien étroit et causal entre la production de radicaux libres suite à la réduction par la QR2 et l'activité antiplasmodiale de ces composés. Des expériences similaires ont été menées sur des érythrocytes sains et parasités ainsi que sur des cellules CHO natives et transfectées avec de la QR2. Elles ont pu démontrer que la production de radicaux libres variait en fonction des niveaux d'expression de la QR2 et de la nature du substrat testé et de sa valeur CI50 sur P. falciparum (Fig.2).
À ce jour, les propriétés antipaludiques des composés INOD ont été imputées à leur capacité à inhiber la hQR2. Or, les structures cristallines des composés INOD liés à la hQR2 associées à des mesures cinétiques et de RPE indiquent que la hQR2 réduit les INOD et les indolones pour donner des composés instables ayant tendance à se ré-oxyder spontanément et à produire des radicaux libres fatals aux érythrocytes parasités. Ces résultats indiquent que les substrats de la hQR2, plutôt que ses inhibiteurs, représentent une nouvelle classe de molécules antipaludiques prometteuses.