Maladie de Huntington - La structure des inclusions présentes dans le cerveau de patients atteints révélée par microspectroscopie
La maladie de Huntington est une maladie neurodégénérative caractérisée par la formation d’agrégats protéiques (inclusions) dans certaines régions cérébrales. La structure secondaire des protéines agrégées dans ces inclusions est encore inconnue, alors qu’elle est suspectée de jouer un rôle majeur dans la maladie. Des chercheurs de l’Université Paris Descartes/CNRS, en collaboration avec les scientifiques de la ligne SMIS, ont utilisé la microspectroscopie infrarouge par rayonnement synchrotron pour caractériser ces agrégats dans le cerveau de patients post-mortem. Cette étude a révélé que leur structure varie en fonction de la localisation subcellulaire ou tissulaire des agrégats, et selon que le patient est atteint de la forme adulte ou juvénile de la maladie.
Une maladie neurodégénérative à agrégation protéique
La maladie de Huntington (MH) affecte 6000 personnes en France. C’est une maladie neurodégénérative qui associe des troubles moteurs, des troubles du comportement et une démence. Elle résulte d’une mutation qui touche un gène codant pour une protéine essentielle au fonctionnement du corps humain : la huntingtine. Cette protéine contient une répétition du même acide aminé, la glutamine (symbole : Q), associés en une longue chaîne (polyQ). Cette chaîne compte 20 à 35 glutamines chez les individus sains. Chez les patients atteints de la forme adulte le nombre de glutamines est de 36 à 60, pour atteindre plus de 60 résidus chez ceux souffrant de la forme juvénile, beaucoup plus rare et plus sévère. La pathologie se caractérise surtout par une dégénérescence progressive prononcée du striatum (structure nerveuse, également appelée « corps strié », située sous le cortex), mais également du cortex, régions dans lesquelles se forment spécifiquement les inclusions. Ces dernières sont se trouvent majoritairement dans le cytoplasme des cellules dans les cas adultes et dans les noyaux cellulaires dans les cas juvéniles.
Importance de la structure secondaire des agrégats protéiques
Des données récentes ont montré que la structure secondaire adoptée par les protéines dans des agrégats de polyQ est influencée par les conditions expérimentales, et que cette structure jouerait un rôle décisif dans la toxicité cellulaire. Ainsi, une simple variation de la température peut modifier à la fois la structure d’un peptide polyQ et sa cytotoxicité. Cependant, la structure des agrégats qui se forment dans le cerveau des patients reste encore inconnue, et rien ne prouve que les agrégats formés in vitro reproduisent la structure des agrégats des malades. Caractériser leur structure est donc de la plus haute importance pour mieux comprendre la maladie.
Analyse de la structure secondaire des inclusions protéiques par microspectroscopie infrarouge synchrotron
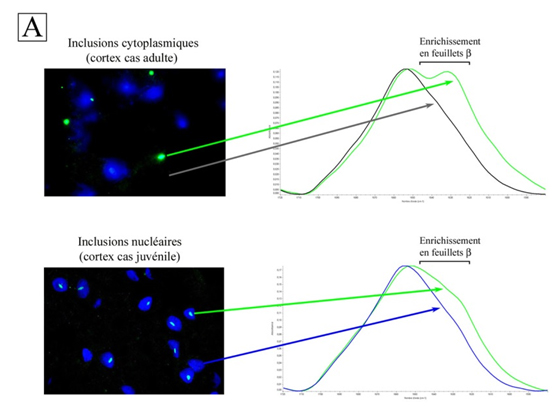
Pour y parvenir, des chercheurs de l’Université Paris Descartes/CNRS, associés à des scientifiques de la ligne SMIS ont analysé des échantillons de cerveaux de patients atteints de la MH par microspectroscopie infrarouge (IR) utilisant le rayonnement synchrotron sur SMIS. Du fait de la petite taille des inclusions (quelques microns), la source IR synchrotron, d’une haute sensibilité, s’est avérée indispensable. Les chercheurs ont acquis des spectres IR des différents types d’inclusions et de leurs compartiments témoins (cytoplasmes et noyaux). Ils se sont ensuite focalisés sur la bande amide I (1600-1720 cm-1), une région spectrale très sensible à la structure secondaire des protéines. L’analyse des différences entre les spectres des inclusions et des témoins a révélé leurs caractéristiques structurales.
Polymorphisme structural des inclusions et lien avec la dégénérescence neuronale
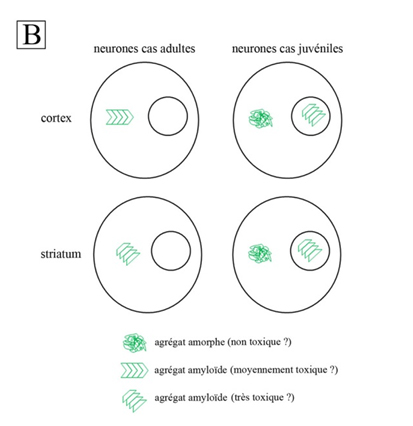
Ainsi, les inclusions cytoplasmiques du cortex et du corps strié des patients adultes sont toutes deux fortement enrichies en feuillets b, indiquant une structure amyloïde1, mais leurs spectres IR présentent aussi des différences (fig. 1A). Leurs conformations amyloïdes sont donc différentes. Le fait que la dégénérescence soit plus prononcée dans le corps strié que dans le cortex des cas adultes suggère que la structure amyloïde des inclusions du corps strié est plus toxique pour les neurones que celle du cortex. Quant aux cas juvéniles, leurs inclusions nucléaires ont une conformation amyloïde comparable aux inclusions du corps strié des cas adultes, tandis que leurs inclusions cytoplasmiques constituent des agrégats amorphes sans structure amyloïde. Les inclusions nucléaires seraient donc toxiques chez le patient juvénile, alors que les inclusions cytoplasmiques seraient inoffensives.
Conclusion
Ce travail décrit un tableau complexe de l’agrégation (fig. 1B) et renforce l’hypothèse d’un lien entre la structure des agrégats et leur toxicité neuronale. Les chercheurs vont maintenant vérifier expérimentalement la toxicité des conformations amyloïdes décrites dans cette étude et chercher à en comprendre les mécanismes. La flexibilité des agrégats protéiques pourrait, par exemple, dépendre de leur conformation amyloïde, permettant ou non l’exposition de la polyQ à leur surface. Cette dernière pourrait ainsi interagir anormalement avec des composants cellulaires, perturbant leur activité et conduisant à la mort de la cellule.
1 – amyloïde : amyloïde signifiait au départ « qui ressemble à l’amidon ». A cette définition histopathologique est venue s’ajouter une définition plus récente, liée aux techniques de biophysique. Selon cette dernière définition, les fibres amyloïdes sont caractérisées par diffraction aux rayons X par des motifs structuraux dits en « cross-b».
La microspectroscopie infrarouge (qui a une plus basse résolution que la diffraction aux rayons X), permet également de distinguer les fibres amyloïdes des autres types de fibres protéiques par leur contenu en feuillets b. La « signature » des fibres amyloïdes en IR est le signal entre 1620 et 1630 cm-1, au niveau de la bande amide I. Une augmentation de l’intensité est considérée comme une preuve de la présence d’un agrégat protéique amyloïde.