Localisation et quantification d'antibiotique à l'intérieur des bactéries
La résistance bactérienne aux antibiotiques est un problème majeur de santé publique. La quantification de l’accumulation des antibiotiques est un paramètre crucial qui détermine leur activité et utile pour le développement de nouvelles molécules antibactériennes. A l’échelle de la bactérie, la microscopie à fluorescence UV permet de suivre la cinétique d’accumulation d’un antibiotique.
Dans cette étude, dans le but de quantifier cette accumulation dans des bactéries isolées, les équipes MCT (Université Aix-Marseille) et DISCO (Synchrotron SOLEIL) ont couplé des résultats de microscopie à fluorescence UV obtenus sur la ligne de lumière DISCO à la technique de cryo microscopie de fluorescence X sur la ligne de lumière ID16A (ESRF). Leurs résultats ouvrent une nouvelle voie pour l'étude des antibiotiques métalliques, qui suscitent un intérêt croissant.
L’activité des antibiotiques dépend de leur capacité à s’accumuler à l’intérieur des bactéries. La surproduction des pompes d’efflux (protéines situées dans la membrane des bactéries, capables d’exporter l’antibiotique hors de la bactérie) couplée à la perte ou à la diminution de la production des porines (protéines, présentes dans les membranes externes de certaines bactéries, formant des canaux permettant l'entrée des antibiotiques) entraîne bien souvent une chute de la concentration intracellulaire des antibiotiques en-dessous d’un seuil critique pour leur activité, et qui sont à l’origine des phénotypes de multirésistance. Dans ce cadre, la quantification de l’accumulation des antibiotiques est cruciale afin de guider le développement de nouvelles molécules antibactériennes pour limiter leur reconnaissance par les pompes d’efflux et optimiser leur perméation à travers la membrane externe.
Pendant plusieurs années, l’unité MCT - Membranes et Cibles Thérapeutiques - de Aix Marseille Université a développé des approches basées sur les propriétés de fluorescence intrinsèques de certains antibiotiques utilisés en thérapeutique humaine, comme les fluoroquinolones. A l’échelle de la population bactérienne, la spectrofluorimétrie offre un moyen robuste de quantifier l’accumulation d’antibiotiques après différents temps d’exposition. A l’échelle de la bactérie unique, la microscopie à fluorescence UV basée sur le rayonnement synchrotron permet de suivre les cinétiques d’accumulation des antibiotiques. Cette approche à l’echelle de la bactérie est toutefois limitée par sa résolution spatiale d’environ 100 nm et par l’absence de calibration de la fluorescence ne permettant pas de quantifier des concentrations en antibiotiques dans des bactéries isolées. La microscopie de Fluorescence des Rayons X (XRF) apparaît comme une technique pertinente pour lever ces limitations.
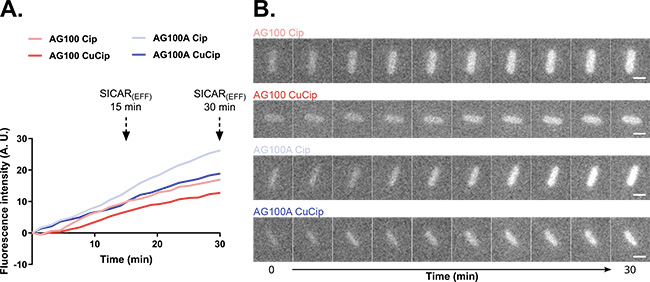
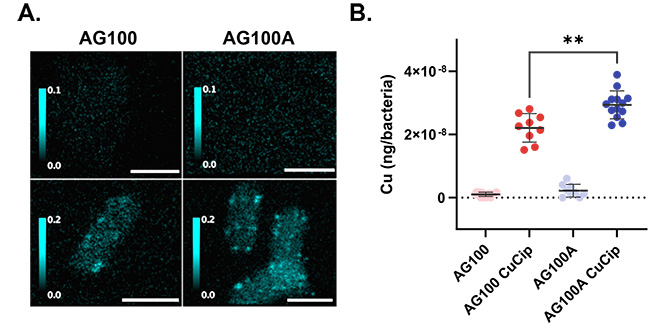
Pour quantifier et localiser l’accumulation d’un antibiotique dans des bactéries isolées, un dérivé métallique d’une fluoroquinolone a été utilisé, la présence de métal étant détecté par XRF. Sa quantification à l’echelle intracellulaire dans des bactéries E. coli pourvues ou dépourvues d’efflux a fourni des résultats semblables à ceux obtenus par les techniques de fluorescence UV sur la ligne DISCO avec la fluoroquinolone “non métallique” (figure 1), validant l’utilisation de ce dérivé pour cette étude. De plus, l’utilisation de XRF en conditions cryogéniques pour quantifier l’accumulation d’un antibiotique a permis de visualiser, à très haute resolution spatiale (20 nm), la distribution d’un antibiotique au sein des bactéries isolées (figure 2). Ces résultats permettent d’ouvrir une nouvelle voie pour l’étude de molécules métalliques présentant une activité antibactérienne par microscopie XRF.
Les techniques de microscopie à haute résolution spatiale sont des outils essentiels à l’étude structurelle d’un échantillon biologique. Les approches synchrotron utilisées ont chacune des caractéristiques propres qui permettent d’étudier l’échantillon sous différents aspects. L’observation de cellules vivantes en microscopie à fluorescence UV, ou proches de leur état natif en cryo-SXT (Soft Xray Tomographie) et microscopie XRF, offre un avantage non négligeable qu’est l’absence de traitement chimique lors la préparation des échantillons. La préservation des structures et de la composition chimique d’un échantillon est en effet essentielle. La cryomicroscopie électronique, qui n’a pas pu être utilisée au cours de ce projet, fait également partie de ces techniques permettant l’étude d’échantillon biologique proche de l’état natif. La complémentarité des approches permet d’améliorer la vue d’ensemble de la structure et de la composition d’un échantillon.
Par ailleurs, les techniques d’imagerie basées sur le rayonnement synchrotron permettent de suivre, quantifier et localiser l’accumulation d’antibiotiques, nécessaire pour comprendre et contourner les mécanismes à l’origine de la diminution de l’accumulation des antibiotiques et surmonter le phénomène de multirésistance aux antibiotiques.