Les petites GTPases à l'interface membranaire, regardées de plus près
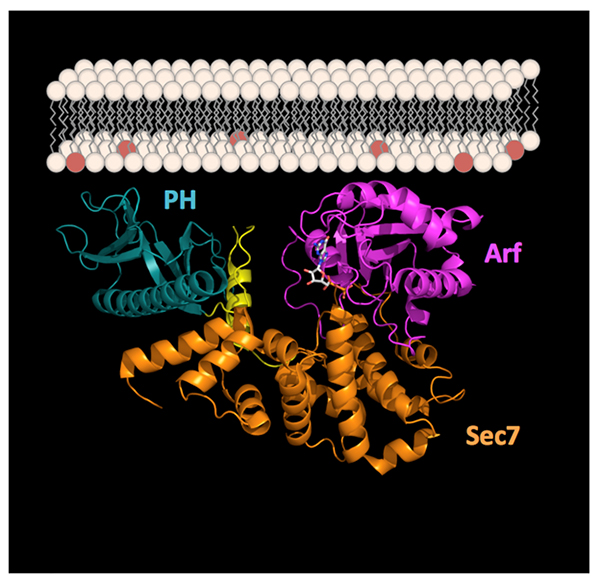
Les petites GTPases de la famille Arf sont des organisateurs clé du trafic cellulaire, processus qui d les protéines et les lipides à des endroits précis dans les cellules où elles peuvent remplir leurs fonctions. L'équipe de Jacqueline Cherfils, du Laboratoire d’Enzymologie et Biochimie Structurales, CNRS, Gif-sur-Yvette, a capturé une petite GTPase de la famille Arf dans un complexe avec son activateur dans une conformation qui simule son interaction avec les membranes, mettant en évidence la façon dont les membranes et les régulateurs s'associent pour optimiser l'activation et l'adressage.
Les petites GTPases forment une superfamille qui contrôle de nombreux aspects de la logistique des cellules, notamment le trafic membranaire, la dynamique du cytosquelette d'actine et la transduction de signaux. Elles fonctionnent comme des interrupteurs moléculaires alternant entre un état inactif, lié au GDP, et un état actif, lié au GTP. L'activation des petites GTPases par échange GDP/GTP est strictement contrôlée par leurs facteurs d'échange nucléotidiques (GEFs). Comment les régulateurs des petites GTPases, tels que les GEFs, sont eux-mêmes régulés et comment cette régulation est couplée aux membranes et aux lipides, sont des questions importantes qui restent en suspens. Cette étude présente la structure cristalline d'un complexe entre une petite GTPase de la famille Arf (une famille qui contrôle la plupart des aspects du trafic vésiculaire des cellules eucaryotes) et un de ses GEFs impliqué dans la régulation de l’endocytose et dans le cancer. Ce complexe a été capturé dans le cristal dans une conformation qui imite son interaction à l'interface avec les membranes. En combinaison avec l'analyse par spectroscopie de fluorescence de la réaction d'échange GDP/GTP reconstituée sur des membranes artificielles, la structure dévoile la grande efficacité de l'activation des Arf GTPases par ce GEF, obtenue par l'optimisation simultanée du recrutement du complexe à la membrane et de son activité d’échange nucléotidique.