Legionella : nouvelles données sur le détournement du fonctionnement cellulaire pendant l’infection
Une étude, menée sur les lignes PROXIMA 2A et SWING du synchrotron SOLEIL par des chercheurs du Centre International de la Recherche en Infectiologie (Lyon) en collaboration avec des scientifiques de l’Université de Leicester (UK), a permis de déterminer l’un des processus utilisé par la Legionella, bactérie de la légionellose, pour contaminer les cellules hôtes.
La maladie du légionnaire (ou légionellose) est une forme agressive de pneumonie. La bactérie responsable, Legionella, se transmet par l’eau et est souvent présente dans les canalisations urbaines ou les citernes. Au cours de l’infection, les bactéries envahissent les cellules épithéliales pulmonaires et les macrophages et s’y reproduisent rapidement.
Dans les cellules eucaryotes, la phosphorylation en cascade des protéines intervient comme « interrupteur » pour contrôler les processus cellulaires, ou encore dans les voies de signalisation cellulaire. Or, il est aujourd’hui avéré que certaines bactéries pathogènes sont capables de détourner ces voies de signalisation afin de favoriser l’invasion des cellules cibles et leur propre réplication. Pour ce faire, la bactérie injecte des protéines qui phosphorylent et ainsi modifient l’activité des protéines des cellules hôtes.
Une nouvelle forme dimérique qui stabilise les éléments catalytiques essentiels
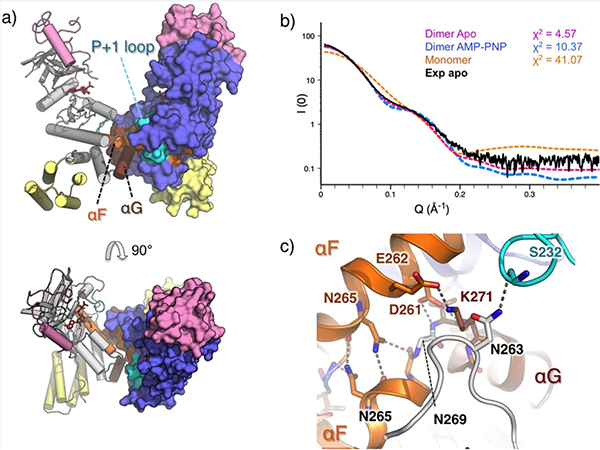
Les scientifiques, menés par Laurent Terradot (IBCP, Lyon), se sont ici intéressés à l’une de ces protéines : LegK4, dont la structure a pu être résolue à partir de données collectées sur la ligne PROXIMA2. Il est apparu que LegK4 est constituée d’un domaine de type kinase (enzyme responsable de la phosphorylation) eucaryote, auquel s’ajoutent une coiffe originale et des domaines FHB (de type flavo hémoglobine).Les données structurales ont été obtenues avec et sans substrat (AMP-PNP, analogue non hydrolysable de l’ATP), montrant que la poche de liaison aux nucléotides, caractéristique des kinases, est ici modifiée. Autre caractéristique remarquable, LegK4 est capable de s’auto-assembler pour générer une interface dimérique encore jamais observée dans la super famille des kinases. Ce dimère est stabilisé par un segment d’hélice a (αG), qui joue habituellement un rôle important dans l’ancrage de la boucle d’activation des kinases intervenant dans leur liaison à leur substrat. L’existence de ce nouveau mode de dimérisation a également été confirmée par étude par diffusion X aux petits angles (SAXS) sur la ligne SWING.
Les études enzymatiques montrent que LegK4 est active de façon constitutive, et les données structurales précisent que le dimère stabilise cette conformation active en l’absence de phosphorylation.
Impact
L’intervention d’effecteurs bactériens de type kinase tels que LegK4 est une stratégie fréquemment utilisée par les pathogènes pour détourner les défenses des cellules hôtes. Alors que les protéines identifiées jusqu’à présent contenaient des domaines catalytiques de type kinase assez sommaires, cette structure est plus proche des kinases eucaryotes classiques, avec cependant des adaptations remarquables. En particulier, la liaison au nucléotide n’implique pas la boucle d’activation « traditionnelle », riche en glycine, mais fait intervenir des acides aminés inhabituels appartenant à des éléments structuraux proches.
Le dimère, ainsi que la boucle d’activation atypique, suggèrent une explication structurelle à l’activité constitutive de LegK4. Des comparaisons de séquence indiquent que certains de ces éléments pourraient exister chez LegK1 et d’autres membres de cette famille de protéines.
Cette nouvelle structure porte également à soupçonner des mécanismes spécifiques de régulation de la kinase qui pourraient être utilisés par la bactérie pour détourner différentes voies de la cellule hôte.
Cette étude ouvre la voie à d’autres recherches visant à mieux comprendre le rôle de ces kinases de type eucaryote au cours de l’infection bactérienne.
(a) Vue de côté (en haut) et du dessus (en bas) du dimère, avec la chaîne A en grise montrée comme une surface et la chaîne B en bleue (en ruban). La coiffe et les domaines FHB des deux chaînes sont colorés respectivement en rose et en jaune.
(b) Comparaison des courbes SAXS expérimentale (noire) et théoriques de apo- LegK41-445 (monomère en orange, dimère en magenta et dimère AMP-PNP • LegLegK41-445 en bleu). Les Χ2, obtenus avec un serveur FOXS, sont indiqués.
(c) Vue détaillée de l’interface du dimère colorée comme en (a) avec les résidus participants représentés en balles et en bâtons.