La formation et la relaxation de diélectrons solvatés observées pour la première fois
Dans les liquides tels que l'eau ou l'ammoniac liquide, les électrons solvatés existent sous forme isolée, fortement confinés dans des cavités formées dans le solvant et, selon diverses hypothèses scientifiques, ils peuvent également s'associer par paires (diélectrons) dans certaines conditions. Cependant, jusqu'à présent, ces diélectrons solvatés font l'objet de nombreuses spéculations et n'ont jamais été observés directement.
Des expériences menées sur la ligne DESIRS ont permis d’apporter des preuves directes, étayées par des calculs de chimie quantique, de la formation de ces diélectrons par excitation avec de la lumière ultraviolette dans de minuscules gouttelettes d'ammoniac contenant un seul atome de sodium. Les résultats sont publiés dans le journal Science.
Les électrons solvatés sont surtout connus dans les solutions de métaux alcalins dans l'ammoniac liquide, mais ils ont également été observés dans d'autres systèmes. Les solutions d'ammoniac alcalin sont utilisées pour de nombreuses réactions chimiques à grande échelle dans l'industrie, principalement en raison de la grande réactivité chimique des électrons solvatés, qui agissent comme un puissant agent réducteur. Dans d'autres solvants comme l'eau, les électrons solvatés apparaissent après l'exposition aux rayonnements ionisants et peuvent être nocifs (génotoxiques) pour les biomolécules, contribuant fortement aux processus de dommage des matériaux biologiques causés par les rayonnements.
Dans les solutions d'ammoniac alcalin, l'existence de diélectrons solvatés a pu dans le passé être déduite des propriétés magnétiques des solutions qui dépendent de leur concentration. En raison des similitudes qui existent entre la plupart des propriétés des électrons solvatés et celles des diélectrons, aucune expérience n'avait permis de distinguer les deux espèces. Par conséquent, la plupart des connaissances sur les diélectrons solvatés provenaient jusqu'à présent de calculs théoriques qui n'avaient pas pu être vérifiés expérimentalement.
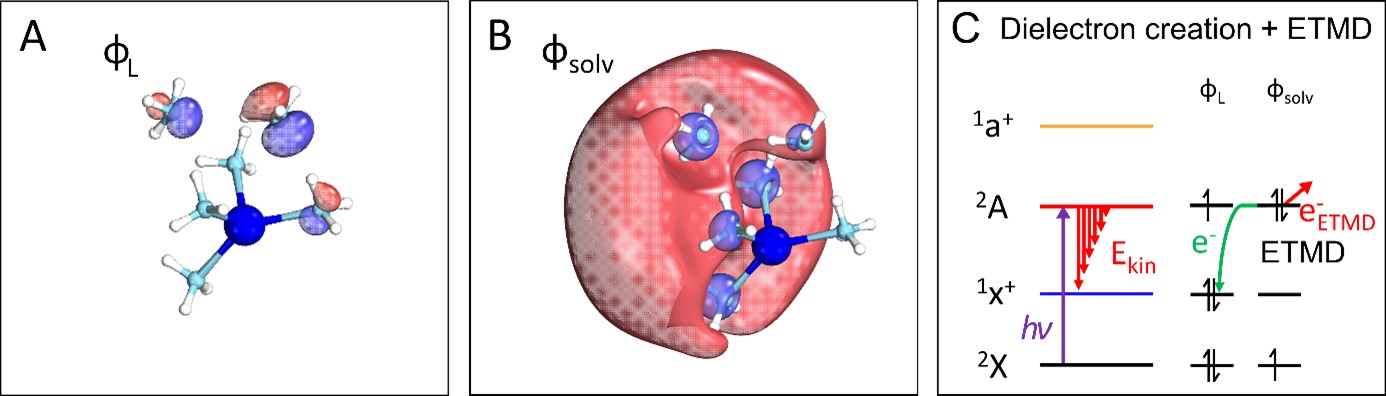
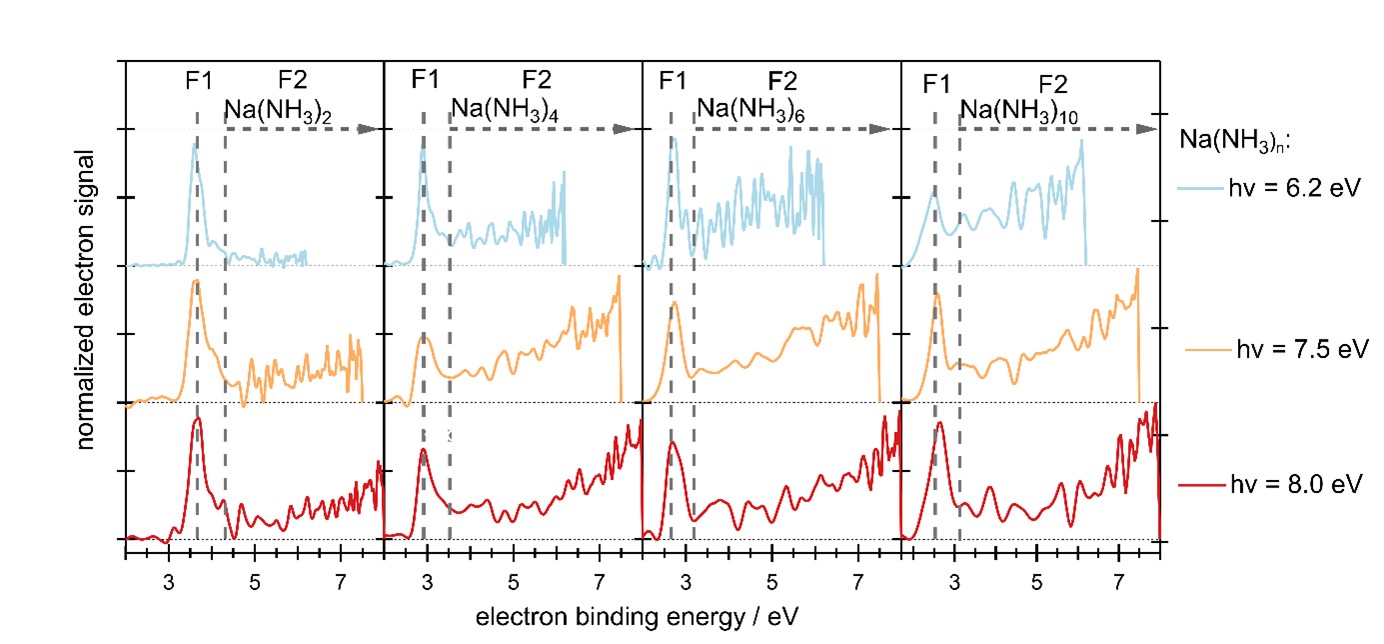
Lors d'une expérience récente sur les agrégats d'ammoniac dopés au sodium Na(NH3)n, réalisée avec le spectromètre de coïncidence électron/ion DELICIOUS III sur la ligne DESIRS, des scientifiques de SOLEIL, de l'université de Fribourg (Allemagne), de l'ETH Zurich (Suisse) et de l'université d'Auburn (États-Unis) ont induit la formation de diélectrons en utilisant la lumière UV/VUV pour transférer l’un des électrons d'une molécule d'ammoniac (voir figure 1A) vers un électron solvaté préalablement existant de façon isolée (voir figure 1B). Dans cet état excité, l'orbitale de l'électron solvaté est occupée par deux électrons appariés, c’est-à-dire un diélectron. La relaxation des paires d'électrons formées laisse une signature unique sur les spectres de photoémission d’électrons, lorsque l'un des deux électrons retourne vers la molécule d'ammoniac (le solvant), tandis que l'autre est éjecté du cluster d’ammoniac avec une faible énergie cinétique.
En raison de ce processus, appelé relaxation induite par transfert d'électrons (ETMD, représenté schématiquement à la figure 1C), la signature des diélectrons dans le spectre photoélectronique diffère fortement de la signature des électrons solvatés simples (voir figure 2). Jusqu'à présent, des processus ETMD similaires ont été principalement observés à des énergies de photons beaucoup plus élevées, dans la gamme des rayons XUV à X mous. En accord avec les calculs de chimie quantique, les signatures des diélectrons solvatés ont été observées dans une large gamme d'énergies de photons UV/VUV et pour toutes les tailles de clusters examinées (1-20 molécules d'ammoniac), ce qui suggère que des processus identiques peuvent se produire en phase liquide.
Ces résultats constituent les premières signatures directes de diélectrons solvatés et sont un exemple particulier et donc intéressant d'un processus de relaxation induite par transfert d'électrons. En outre, le processus observé pourrait être utilisé pour créer des électrons lents de manière contrôlée, en utilisant la lumière UV produite par les lampes UV disponibles dans le commerce. Des électrons ayant une énergie contrôlée pourraient être utilisés pour des études plus détaillées de la réactivité des électrons solvatés dans les solutions d'ammoniac alcalin et dans d'autres solvants.
Enfin, ces études fondamentales contribuent à améliorer notre compréhension des mécanismes réactionnels fondamentaux et à développer des voies de réaction alternatives utilisant des réactifs moins dangereux et moins nocifs pour l'environnement.