La chiralité induite sur une molécule achirale existe également en dichroïsme circulaire de photoélectrons (PECD)
Les mesures de dichroïsme circulaire ont déjà démontré qu'une molécule achirale(1) peut acquérir une signature spectroscopique chirale(1) lorsqu'elle interagit avec un environnement chiral. Une nouvelle étude, menée sur la ligne de lumière DESIRS, montre que lorsqu'une molécule achirale est en interaction avec une molécule chirale, son exposition à un rayonnement VUV(2) polarisé circulairement entraîne une diffusion asymétrique des photoélectrons(3) éjectés.
Ceci démontre que la chiralité induite peut également être observée dans le dichroïsme circulaire des photoélectrons (PECD(4)). Une telle chiralité induite a des implications structurales et analytiques importantes, dans le contexte de l'intérêt croissant pour le PECD à base de lasers, pour la détermination in situ et en temps réel des excès énantiomèriques(1).
La chiralité induite fait référence à l'apparition d'un signal dichroïque sur une molécule achirale en contact avec un environnement chiral. Un tel effet à longue portée a été observé dans le passé par le biais de diverses spectroscopies chiroptiques, telles que les dichroïsmes circulaires électronique ou vibrationnel, tous deux basés sur une interaction de dipôles électriques et magnétiques, conduisant intrinsèquement à de faibles asymétries dichroïques.
En revanche, le dichroïsme circulaire de photoélectrons (PECD(4)) est un effet spectroscopique chiroptique autorisé dans l'approximation dipolaire électrique, ce qui conduit à des asymétries plus intenses de plusieurs ordres de grandeur. Observé comme une asymétrie avant-arrière dans la distribution angulaire des photoélectrons après l'ionisation d'un système chiral par une lumière polarisée circulairement (CPL(5)), il dépend à la fois de l'état initial, c'est-à-dire de l'orbitale à partir de laquelle l'électron est éjecté, et de l'état final, c'est-à-dire du continuum électronique, et donc de l'énergie cinétique du photoélectron sortant diffusée par le potentiel chiral du cation. En tant que telle, le PECD est très sensible à la conformation moléculaire et à l'agrégation.
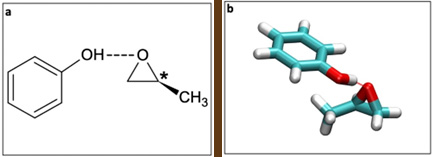
La portée du PECD reste une question ouverte, avec de forts effets mesurés à partir d'orbitales achirales non situées autour du centre chiral. Ces études, cependant, ont été limitées à des distances intramoléculaires (1 ou 2 Å), à la fois pour les PECD de valence et les PECD de cœur. Ici, un consortium collaboratif constitué d’une équipe de l'ISMO (CNRS / Univ. Paris-Saclay) et de l'équipe de la ligne DESIRS s'est concentré sur les complexes moléculaires faiblement liés formés entre le phénol (Phe), un chromophore non chiral, et le méthyloxirane (MOx), (figure 1). Ils ont cherché à évaluer l'influence de l'hôte chiral sur le PECD sur des distances intermoléculaires, qui pourrait conduire à un PECD induit sur la partie achirale.
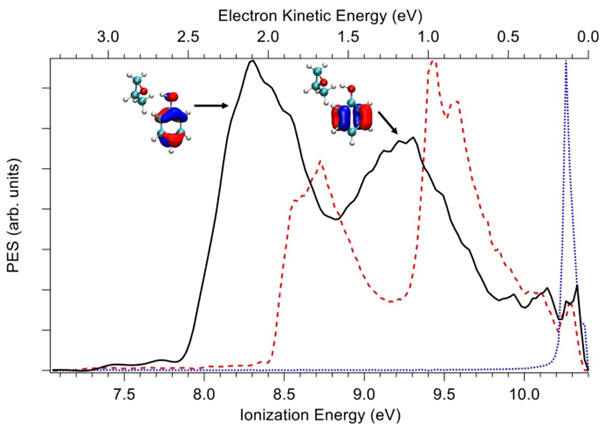
En utilisant le spectromètre de coïncidence à double imagerie électron/ion disponible sur DESIRS, les scientifiques ont enregistré le spectre de photoélectrons (PES(3)) du complexe Phe-Mox montrant deux bandes clairement résolues, correspondant aux deux orbitales les plus externes (HOMO et HOMO-1), toutes deux purement localisées sur les orbitales p achirales aromatiques de la partie phénol (voir Figure 2).
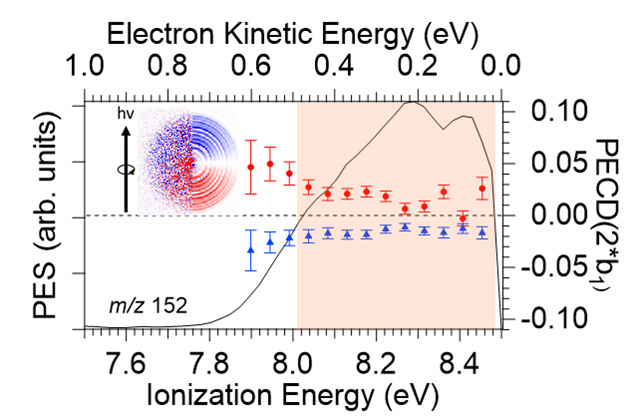
À toutes les énergies de photons étudiées, et en particulier à 8,5 eV, où le MOx chiral ne peut pas être ionisé, une asymétrie PECD claire est mise en évidence, comme le montre la figure 3, avec l’effet miroir attendu entre les complexes de phénol avec les énantiomères (R) et (S) du MOx. L'origine du PECD induit observé sur l'orbitale HOMO achirale du complexe doit provenir du potentiel chiral que subit le photoélectron sortant lors de sa diffusion. Ce premier exemple de manifestation de la chiralité induite dans le PECD sur un chromophore achiral par complexation avec un marqueur chiral souligne le rôle du potentiel de diffusion chiral à longue portée s'étendant aux distances intermoléculaires, ici jusqu'à ~5 Å. En d'autres termes, du point de vue de la partie achirale, la présence de l'hôte MOx chiral offre à l'électron éjecté du phénol un potentiel de diffusion chiral, conduisant à un PECD induit.
Inversement, du point de vue de la fraction chirale, le PECD induit sur le chromophore achiral offre des possibilités analytiques innovantes. En effet, les premières démonstrations du PECD multiphotonique (MP) par laser en 2012 (une décennie après la première démonstration expérimentale avec le rayonnement synchrotron), ont déclenché un important développement du domaine, alimenté par le fort potentiel du MP-PECD en tant qu'outil analytique de table pour étudier les excès énantiomériques in situ en phase gazeuse. Toutefois, en raison du schéma d'ionisation utilisé, qui fait intervenir des photons dans l'UV proche/moyen, ces études se sont jusqu'à présent limitées aux terpènes ou aux espèces porteuses de chromophores. La complexation avec un chromophore achiral pourrait être un moyen d'étendre ces mesures chiroptiques à base de lasers à un large éventail d'espèces chirales qui ne peuvent pas être excitées dans l'UV proche/moyen, y compris par exemple les acides aminés non aromatiques, dont le PECD n'a été étudié jusqu'à présent que par ionisation synchrotron à un photon, une technique qui, contrairement au MP-PECD laser, ne permet pas une sélection directe des conformères (6).
--------------------
GLOSSAIRE
1 - Chiralité/énantiomère: Un objet est dit chiral s’il existe sous deux formes non superposables mais images l’une de l’autre dans un miroir. C’est le cas des mains (ou des pieds !), des hélices, mais aussi de nombreuses molécules (par exemple celles possédant un carbone asymétrique relié à 4 groupement chimiques différents) pour lesquelles on parle d’énantiomère gauche ou droit.
2 - VUV : ultraviolet du vide, rayonnement ultraviolet absorbé par l'air. Correspond à la gamme de longueurs d'onde 30-200 nm (6-40 eV), c'est-à-dire à l'excitation des électrons de la couche de valence des atomes et des molécules.
3 - Photoémission / photoionisation : action de la lumière qui arrache un électron à la matière : c’est l’effet photoélectrique dans lequel l’énergie du photon incident (hn) se partage entre le travail d’extraction de l’électron (énergie de liaison) et l’énergie cinétique du photoélectron émis (Ek). La spectroscopie de photoélectron (PES, en anglais) consiste à mesurer la distribution des énergies Ek pour un photon incident donné, permettant ainsi de déterminer les niveaux d’énergie (de liaison) des électrons de la molécule (ce qui correspond à l’énergie des différentes orbitales moléculaires). On peut aussi mesurer dans quelles directions sont éjectés les photoélectrons par rapport à un axe donné : on parle de distributions angulaires. Cette distribution (caractérisée par le paramètre b) ne présente pas les mêmes propriétés dans toutes les directions, autrement dit : n’est pas isotrope (b ≠0) car la molécule se « souvient » de la polarisation de la lumière incidente.
4 - Dichroïsme circulaire de photoélectrons (« PECD » en anglais) : La LPC étant un objet chiral (voir (5)), elle va induire des processus énantio-spécifiques quand elle interagit avec un énantiomère donné d’une molécule chirale : ce sont les dichroïsmes circulaires, une reconnaissance chirale entre objets chiraux, comme un gant gauche « reconnaît » une main gauche. Dans le cas de la photoémission d’un énantiomère donné d’une molécule chirale par une LPC d’une hélicité (gauche ou droite) donnée, le PECD se manifeste par une asymétrie avant/arrière par rapport à l’axe de propagation de la lumière, que l’on ne retrouve pas pour une molécule non-chirale. Cette asymétrie s’inverse quand on change d’énantiomère ou d’hélicité de la lumière. La spécificité du PECD, par rapport à d’autres types de dichroïsmes circulaires, est son intensité : de quelques % à quelques dizaines de %. Il est, de plus, très sensible aux structures moléculaires comme les isomères (molécules ayant la même composition atomique, mais un arrangement différent de leurs atomes), ou les conformères.
5 - Lumière polarisée circulairement (LPC) : la polarisation est une propriété géométrique de la lumière, qui décrit le mouvement du champ électrique associé à l’onde lumineuse lors de sa propagation. Dans le cas d’une lumière polarisée circulairement, le champ électrique décrit une hélice (comme un tire-bouchon) qui peut être enroulé dans le sens horaire ou anti-horaire, d’où l’appellation de LPC d’hélicité gauche ou droite. À noter : cette lumière LPC est un objet chiral.
6 - Conformères : de nombreuses molécules, et notamment celles du Vivant, sont « souples » et existent sous forme de plusieurs conformères, obtenus par rotations de groupement chimiques autour d’une liaison chimique ou déformation (inversion) d’un cycle.