Immunité - La diffraction X relève des interactions entre protéines au cœur de la défense contre les pathogènes
En permanence, le système immunitaire identifie et détruit bactéries pathogènes, virus et autres facteurs d’infection. Le système du complément est l’un de ses composants, constitué de nombreuses protéines. Deux laboratoires du Centre de recherche biologique Margarita Salas (CSIC, Madrid), et l’équipe de la ligne PROXIMA-2A sont pour la première fois parvenus à déterminer la structure 3D de C3bi, l’une des protéines du complément, ainsi que celle de C3bi liée à une protéine récepteur du complément, CR3. Les structures obtenues contribuent à une meilleure compréhension globale des processus de marquage des pathogènes en vue de leur élimination, pour lesquels iC3b et CR3 sont des acteurs clés.
Pour nous protéger contre les différents pathogènes auxquels nous sommes en permanence exposés, notre système immunitaire met en œuvre différents acteurs et mécanismes, qui nécessitent un temps d’adaptation pour être actifs (immunité adaptative – avec notamment la production d’anticorps) ou permettent une défense immédiate (immunité innée). Le système du complément est l’un des acteurs de l’immunité innée. Il est composé de plus de 30 protéines qui agissent de manière séquentielle : une protéine en active une autre, qui en active une troisième, etc. – d’où le nom de « cascade du complément ». L’une des fonctions du complément est de contribuer à l’élimination de cellules non reconnues comme faisant partie de notre organisme, en les marquant avec des molécules de signalisation spécifiques (opsonines) ; ces dernières vont ensuite alerter d’autres acteurs du système immunitaire sur la nature étrangère de ces pathogènes. Parfois, les opsonines détruisent elles-mêmes l'agent pathogène en créant des pores dans la surface de sa cellule. Mais, le plus souvent, elles font appel à d'autres cellules immunitaires qui vont phagocyter l'agent pathogène.
Le composant central du système du complément est une grande protéine multidomaine appelée C3, l'une des protéines les plus abondantes dans le sang, dont la structure et la fonction sont étudiées depuis des années. Sa principale fonction est de fixer et de marquer de façon permanente les surfaces « intruses » et les agents pathogènes. Lorsqu’elle se dépose sur ces cibles, C3 subit une modification qui la transforme en une protéine très proche mais dont l'organisation structurale est radicalement différente, appelée C3bi. Le dépôt de C3 est si rapide et efficace qu'en quelques minutes l'agent pathogène est entouré d'un méandre de molécules C3bi. Le système immunitaire peut alors détecter toutes sortes d'agents pathogènes à partir du moment où il reconnait une seule molécule : C3bi. Bien que l'importance de C3bi pour le système immunitaire soit avérée depuis de nombreuses années, sa structure n’a jamais été précisément déterminée, seules des images à faible résolution ont pu être obtenues par microscopie électronique à coloration négative, ou par diffusion des rayons X aux petits angles.
Deux laboratoires du Centre de recherche biologique Margarita Salas (CSIC) de Madrid, en Espagne, et l’équipe de la ligne de lumière PROXIMA-2A de SOLEIL ont collaboré pour dévoiler la structure 3D complète de C3bi par cristallographie aux rayons X. Leurs travaux révèlent l'organisation modulaire de C3bi, caractérisée par un domaine globulaire qui sert de médiateur à l'arrimage à la surface des cellules pathogènes, relié de manière flexible à un corps rigide par un lien d’ancrage d’environ 65 Å.
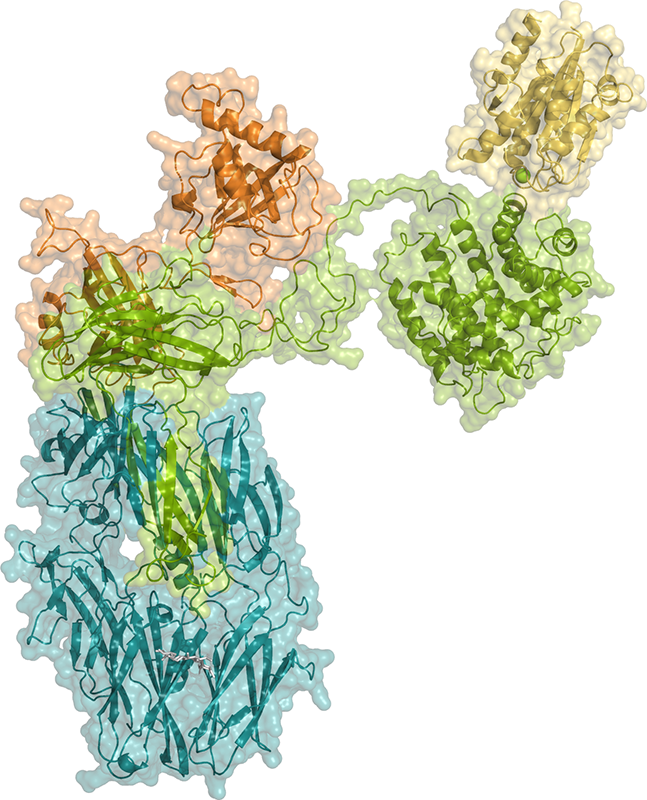
De plus, la structure d’un complexe entre C3bi et la protéine CR3 a également été déterminée (Figure 1). CR3 est une protéine présente à la surface de la plupart des cellules immunitaires, notamment les macrophages et les neutrophiles responsables de l'élimination des agents pathogènes par phagocytose, et c’est un récepteur du complément (CR3 = récepteur du complément 3), auquel se fixe C3bi. La structure du complexe entre C3bi et un domaine de CR3 – appelé αI- montre comment la structure modulaire de C3bi joue un rôle crucial dans la création des surfaces nécessaires à la liaison de CR3. C3bi se trouvant à la surface de l'agent pathogène et CR3 étant fixé à la surface de la cellule immunitaire qui va détruire ce pathogène, le complexe C3bi/CR3 modélise les interactions cellulaires nécessaires à la reconnaissance et la destruction des agents pathogènes par le système immunitaire.
Les cristaux obtenus à partir du complexe C3bi-CR3 αI étaient longs et fragiles, et il était difficile d’enregistrer des données de diffraction X exploitables. Cependant, les scientifiques de PROXIMA-2A ont réussi à obtenir des données de diffraction de rayons X de haute qualité, atteignant une résolution de 3,4 Å, en combinant les propriétés du microfaisceau X de la ligne à une stratégie de collecte de données très méticuleuse.
Ces travaux mettent en évidence le rôle du système du complément dans le marquage de la surface des agents pathogènes afin qu'ils soient reconnus par des récepteurs spécifiques présents à la surface des macrophages et d'autres cellules immunitaires (puis détruits). La structure du complexe C3bi-CR3 αI révèle les mécanismes moléculaires qui sous-tendent ces processus, essentiels au bon fonctionnement du système immunitaire.
Pour nous protéger contre les différents pathogènes auxquels nous sommes en permanence exposés, notre système immunitaire met en œuvre différents acteurs et mécanismes, qui nécessitent un temps d’adaptation pour être actifs (immunité adaptative – avec notamment la production d’anticorps) ou permettent une défense immédiate (immunité innée). Le système du complément est l’un des acteurs de l’immunité innée. Il est composé de plus de 30 protéines qui agissent de manière séquentielle : une protéine en active une autre, qui en active une troisième, etc. – d’où le nom de « cascade du complément ». L’une des fonctions du complément est de contribuer à l’élimination de cellules non reconnues comme faisant partie de notre organisme, en les marquant avec des molécules de signalisation spécifiques (opsonines) ; ces dernières vont ensuite alerter d’autres acteurs du système immunitaire sur la nature étrangère de ces pathogènes. Parfois, les opsonines détruisent elles-mêmes l'agent pathogène en créant des pores dans la surface de sa cellule. Mais, le plus souvent, elles font appel à d'autres cellules immunitaires qui vont phagocyter l'agent pathogène.
Le composant central du système du complément est une grande protéine multidomaine appelée C3, l'une des protéines les plus abondantes dans le sang, dont la structure et la fonction sont étudiées depuis des années. Sa principale fonction est de fixer et de marquer de façon permanente les surfaces « intruses » et les agents pathogènes. Lorsqu’elle se dépose sur ces cibles, C3 subit une modification qui la transforme en une protéine très proche mais dont l'organisation structurale est radicalement différente, appelée C3bi. Le dépôt de C3 est si rapide et efficace qu'en quelques minutes l'agent pathogène est entouré d'un méandre de molécules C3bi. Le système immunitaire peut alors détecter toutes sortes d'agents pathogènes à partir du moment où il reconnait une seule molécule : C3bi. Bien que l'importance de C3bi pour le système immunitaire soit avérée depuis de nombreuses années, sa structure n’a jamais été précisément déterminée, seules des images à faible résolution ont pu être obtenues par microscopie électronique à coloration négative, ou par diffusion des rayons X aux petits angles.
Deux laboratoires du Centre de recherche biologique Margarita Salas (CSIC) de Madrid, en Espagne, et l’équipe de la ligne de lumière PROXIMA-2A de SOLEIL ont collaboré pour dévoiler la structure 3D complète de C3bi par cristallographie aux rayons X. Leurs travaux révèlent l'organisation modulaire de C3bi, caractérisée par un domaine globulaire qui sert de médiateur à l'arrimage à la surface des cellules pathogènes, relié de manière flexible à un corps rigide par un lien d’ancrage d’environ 65 Å.
De plus, la structure d’un complexe entre C3bi et la protéine CR3 a également été déterminée (Figure 1). CR3 est une protéine présente à la surface de la plupart des cellules immunitaires, notamment les macrophages et les neutrophiles responsables de l'élimination des agents pathogènes par phagocytose, et c’est un récepteur du complément (CR3 = récepteur du complément 3), auquel se fixe C3bi. La structure du complexe entre C3bi et un domaine de CR3 – appelé αI- montre comment la structure modulaire de C3bi joue un rôle crucial dans la création des surfaces nécessaires à la liaison de CR3. C3bi se trouvant à la surface de l'agent pathogène et CR3 étant fixé à la surface de la cellule immunitaire qui va détruire ce pathogène, le complexe C3bi/CR3 modélise les interactions cellulaires nécessaires à la reconnaissance et la destruction des agents pathogènes par le système immunitaire.
Les cristaux obtenus à partir du complexe C3bi-CR3 αI étaient longs et fragiles, et il était difficile d’enregistrer des données de diffraction X exploitables. Cependant, les scientifiques de PROXIMA-2A ont réussi à obtenir des données de diffraction de rayons X de haute qualité, atteignant une résolution de 3,4 Å, en combinant les propriétés du microfaisceau X de la ligne à une stratégie de collecte de données très méticuleuse.
Ces travaux mettent en évidence le rôle du système du complément dans le marquage de la surface des agents pathogènes afin qu'ils soient reconnus par des récepteurs spécifiques présents à la surface des macrophages et d'autres cellules immunitaires (puis détruits). La structure du complexe C3bi-CR3 αI révèle les mécanismes moléculaires qui sous-tendent ces processus, essentiels au bon fonctionnement du système immunitaire.