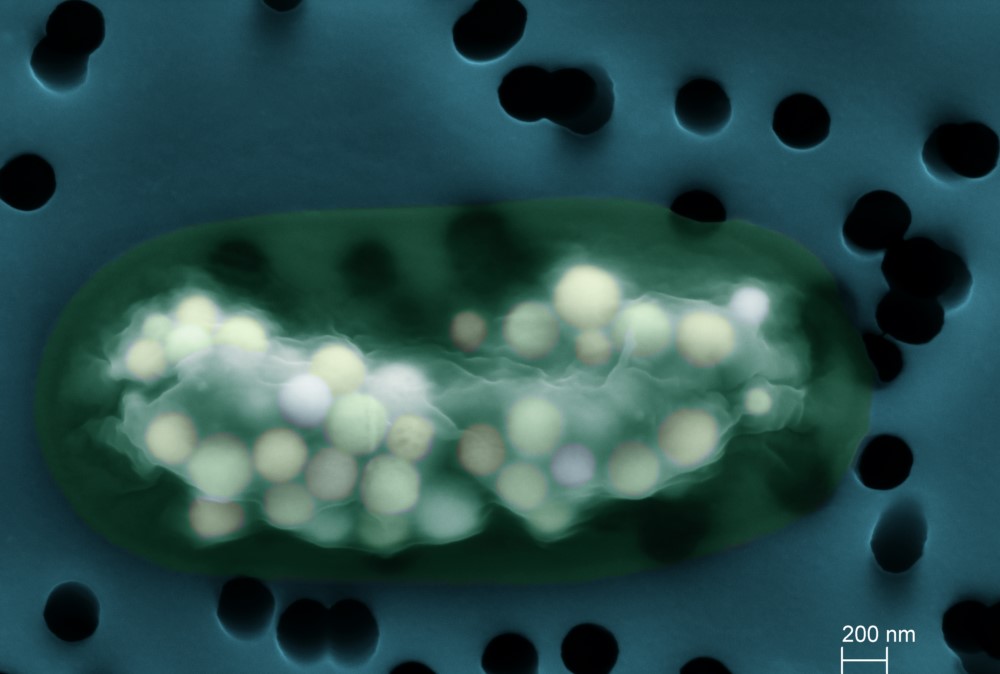
Exploration atomique de précipités calcaires à l’intérieur de bactéries
Certaines bactéries forment des granules calcaires micrométriques à l’intérieur de leurs cellules, stockant ainsi du calcium et du carbone. Leur fonction reste inconnue mais les cellules dépensent de l’énergie pour les synthétiser. Pour mieux prédire le comportement chimique de ces granules, il faut déterminer comment les atomes de calcium et de carbone sont agencés en leur sein. L’utilisation de la ligne de lumière LUCIA a montré que le calcium des granules représente une grande partie du calcium des cellules et que l’agencement des atomes faisait de ces granules des réservoirs modulables permettant de stocker mais aussi de libérer efficacement les éléments chimiques les composant.
Les cyanobactéries sont des bactéries réalisant la photosynthèse oxygénique, un métabolisme utilisant la lumière pour transformer le CO2 en matière organique et oxyder l’eau en dioxygène. Apparues il y a plus de 2,3 milliards d’années, ces bactéries ont eu un impact considérable sur le fonctionnement chimique de la Terre. Premièrement, elles ont oxygéné l’atmosphère (il y a aujourd’hui 20% d’O2 dans l’atmosphère contre 0% il y a 3 milliards d’années). Ensuite, en piégeant le CO2, elles favorisent la précipitation de minéraux carbonatés (e.g., CaCO3), formant des roches conservées dans les archives géologiques. Longtemps, on a pensé que cette biominéralisation cyanobactérienne ne se produisait qu’à l’extérieur des cellules et était un produit secondaire de leur métabolisme. Cependant, il a été découvert que de nombreuses espèces de cyanobactéries formaient des phases carbonatées intracellulairement, suggérant un contrôle biologique beaucoup plus fort. Ces dernières sont diversifiées, abondantes dans certains environnements et il s’agit d’un processus très ancien, interrogeant sur l’impact géochimique de ce processus intracellulaire. Pour mieux comprendre comment ces phases minérales se distinguent des carbonates extracellulaires, une collaboration a été établie entre des membres de l’IMPMC (Paris), de l’ISTerre (Grenoble) et de la ligne de lumière LUCIA du synchrotron SOLEIL.
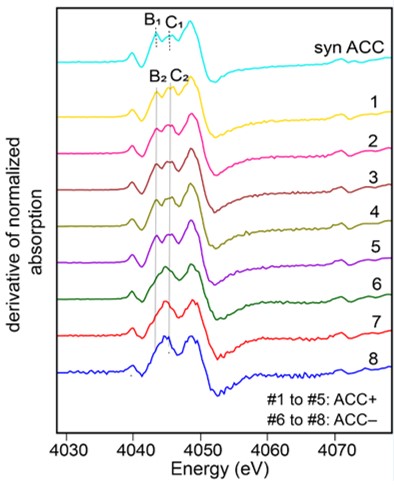
A l’aide de la spectroscopie XANES au seuil K du calcium sur la ligne LUCIA, les scientifiques ont analysé des souches de cyanobactéries formant des CaCO3 intracellulaires, d’autres n’en formant pas, et différentes formes (polymorphes) de CaCO3, cristallisées ou amorphes, synthétisées en laboratoire. Les spectres obtenus montrent des signatures caractéristiques des différentes phases et démontrent que les carbonates de calcium intracellulaires cyanobactériens sont amorphes (ACC : Amorphous Calcium Carbonate), ce qui signifie que les atomes les composant ne sont pas arrangés de manière ordonnée à moyenne et longue distance. Les analyses attestent que le Ca stocké au sein des ACC est très majoritaire, constituant entre 60 et 84% du Ca cellulaire total, le reste correspondant à du Ca complexé par des molécules organiques et du Ca coprécipité dans des polyphosphates.
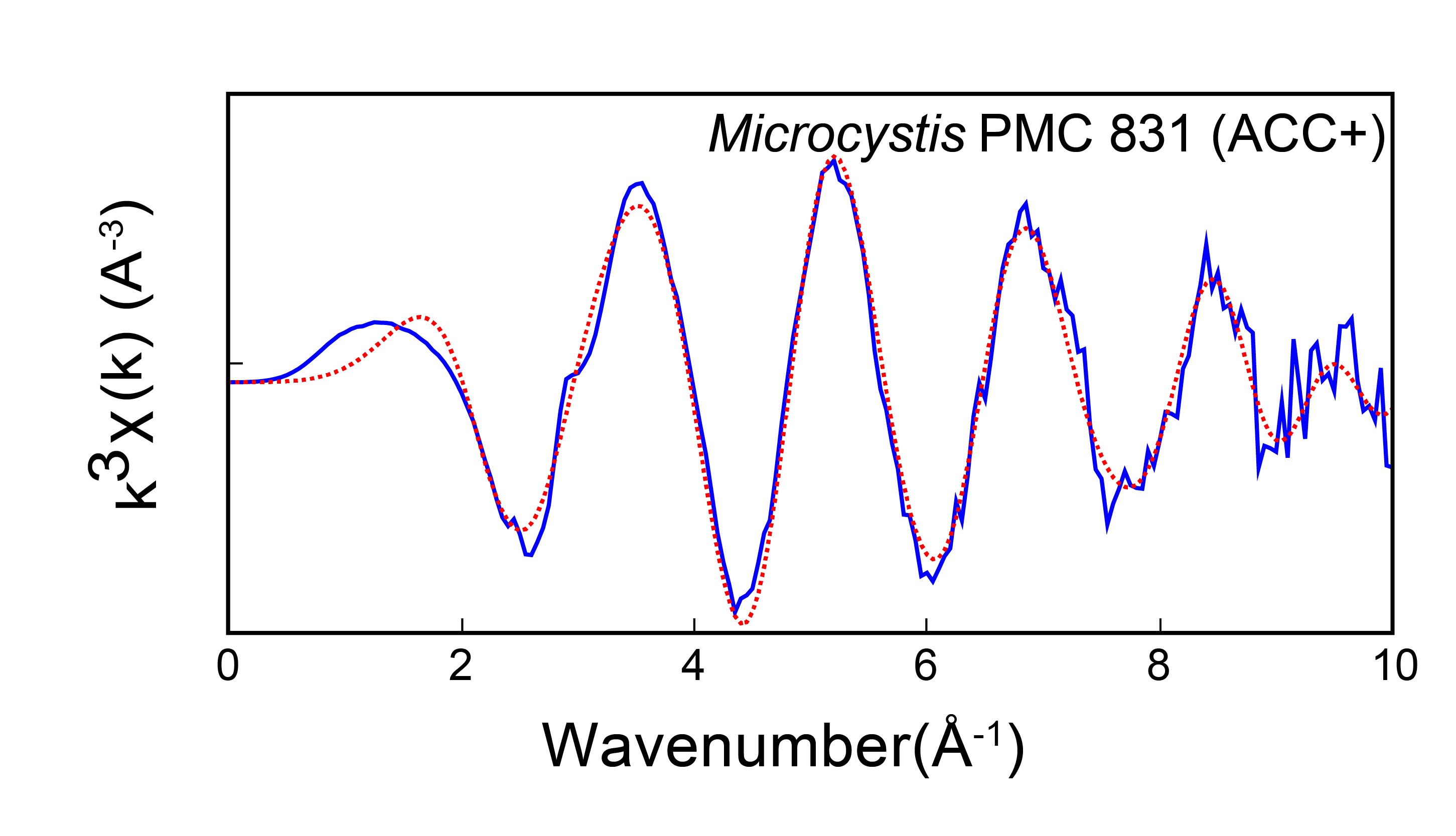
Toujours sur la ligne LUCIA, des spectres EXAFS des cyanobactéries formant des ACC intracellulaires ont été mesurés. La modélisation des spectres obtenus a permis de déterminer la structure locale autour du calcium dans ces ACC. La comparaison avec les structures de carbonates étudiées auparavant a suggéré deux choses : (i) les ACC cyanobactériens ont une structure proche mais avec quelques différences par rapport aux ACC formés par d’autres organismes biologiques ; (ii) si les ACC cyanobactériens sont amorphes à grande échelle, ils ont une structure locale définie et elle est proche de celle de la monohydrocalcite, un carbonate de calcium cristallin avec une molécule d’eau structurale. Ceci suggère que l’ACC cyanobactérien pourrait être hydraté. Or, les ACC hydratés sont plus stables, c’est-à-dire qu’ils ne cristallisent pas spontanément, ce qui pourrait expliquer la stabilité observée des ACC cyanobactériens.
Au final, les inclusions cyanobactériennes de CaCO3 (le CaCO3 se formant et persistant à l’intérieur des cellules) sont amorphes mais montrent une structure locale définie à l’échelle de quelques atomes. Ces carbonates sont vraisemblablement hydratés ce qui limite leur cristallisation spontanée. Ainsi, ces inclusions ont de bonnes propriétés pour stocker de grandes quantités d’éléments chimiques dans les cellules, tout en restant facilement remobilisables du fait de leur forte réactivité et sans cristalliser spontanément ce qui se ferait au détriment de l’intégrité des structures cellulaires.
Dans le futur, les scientifiques aimeraient déterminer le devenir de ces inclusions lorsque les cellules meurent. Peuvent-elles, au contact des solutions extracellulaires, se transformer en des solides cristallins stables dont on retrouverait la trace dans les archives géologiques ?