Épissage de l’ARN – la structure en lasso capturée sur PROXIMA-1 !
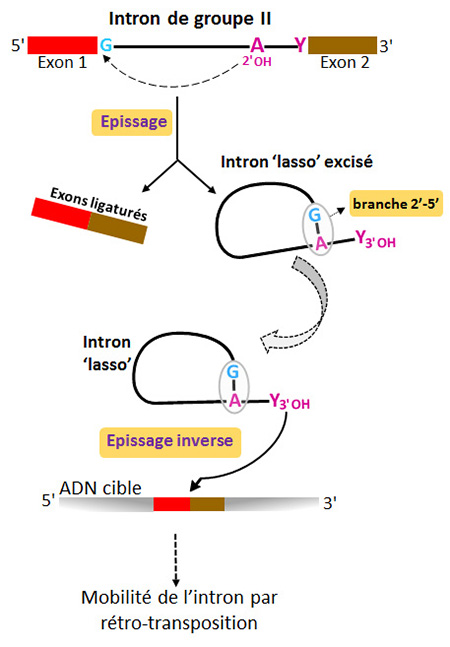
Les introns de groupe II sont de grands ARN catalytiques et des éléments génétiques mobiles. Nés chez les bactéries, ils sont très probablement les ancêtres des introns nucléaires eucaryotes et de leur appareil d’épissage, le spliceosome. Dans les deux systèmes d’épissage, l’intron est excisé dans une conformation en ‘lasso’ due à une liaison spécifique 2’-5’. Des données collectées sur la ligne PROXIMA-1 ont permis à des chercheurs de l'Institut de Biologie Intégrative de la Cellule (I2BC) de déterminer deux structures cristallines d’un intron ‘lasso’ bactérien. Ces structures dévoilent les raisons de l’extrême conservation de la conformation ‘lasso’ au cours de l’évolution. Ce travail a été publié le 2 décembre 2016 dans la revue Science.
Les introns de groupe II sont de grandes molécules d’ARN capables de catalyser des réactions chimiques. Ce sont des ribozymes et cette propriété leur permet de s’auto-exciser d’un ARN précurseur (processus d’épissage) en l’absence de tout facteur protéique. Ces introns – très répandus chez les bactéries et dans les organites (mitochondrie et chloroplaste) – ont une structure secondaire organisée en six domaines (I à VI) et abritent dans leur domaine IV une phase ouverte de lecture codant pour une transcriptase inverse. En association avec leur transcriptase inverse, les introns de groupe II se comportent comme des éléments génétiques mobiles, capables de coloniser un ADN cible par un processus appelé rétro-transposition qui contribue à la diversification des génomes. Enfin, les introns de groupe II sont très probablement les ancêtres évolutifs des introns des ARN pré-messagers nucléaires eucaryotes et de leur machinerie d’épissage, le spliceosome. Cette hypothèse évolutive repose sur de nombreuses similarités au niveau structural et fonctionnel.
Parmi celles-ci, la plus frappante est certainement le mécanisme d’épissage qui aboutit à la ligature des exons et à la libération de l’intron sous forme d’une molécule branchée, appelée ‘lasso’ ou ‘lariat’ (figure 1). Dans les deux systèmes d’épissage, la conformation en ‘lasso’ résulte de la création d’une liaison phosphodiester 2’-5’ entre une adénosine intronique très conservée et le premier nucléotide de l’intron, presque toujours une guanosine. Chez les introns de groupe II, l'adénosine du point de branchement fait partie du petit domaine VI, à l'extrémité 3' de la molécule. Une fois libéré, l’intron ‘lasso’ est capable d’envahir une cible ADN par épissage inverse (ou rétro-épissage). Ce mécanisme, qui consiste en la catalyse des réactions d’épissage en sens inverse, est la première étape du processus de rétro-transposition.
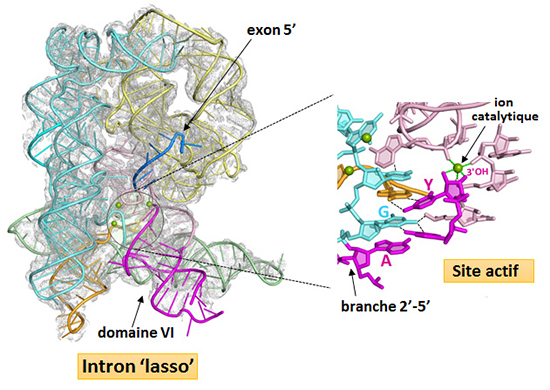
Les raisons du succès évolutif de la conformation en 'lasso', restées inconnues pendant trente ans, viennent d’être mises en lumière par Maria Costa et ses collègues de l'Institut de Biologie Intégrative de la Cellule (I2BC), qui ont cristallisé la forme 'lasso' d’un intron de groupe II bactérien, seul, ou en complexe avec un analogue non réactif de l'exon 5'. Les données de diffraction des rayons X collectées à partir de ces cristaux sur la ligne PROXIMA-1 leur ont permis de résoudre les structures de la forme 'lasso' libre ou complexée, à 3,4 et 3,5 Å de résolution, respectivement.
Ce travail, récemment publié dans la revue Science, révèle pour la première fois que la branche 2’(A)-5’(G) joue un rôle crucial dans l’assemblage du site actif de l’intron. En mettant en interaction les nucléotides conservés aux deux extrémités de l’intron, la branche participe directement à la définition des jonctions d’épissage, accélère la réaction d’excision de l’intron par quelque trois ordres de grandeur et contribue de façon décisive à la fidélité du processus global d’épissage. De plus, ces structures montrent que le centre catalytique de l’intron 'lasso', une fois ce dernier libéré de l’ARN précurseur, est maintenu dans une configuration compétente pour l’initiation de l’épissage inverse (figure 2).
Des données de diffraction des rayons X de cristaux dérivés - issus d’un trempage de cristaux natifs dans une solution d'atomes d'ytterbium (Yb3+) - ont été collectées sur la ligne PROXIMA-1 au seuil de l’Yb3+ et utilisées pour générer une carte des différences anomales. Celle-ci a révélé la présence de deux sites de liaison forts pour les ions Yb3+ dans le centre réactionnel. L'ytterbium se fixant à l’ARN avec la même géométrie de coordination que le magnésium, les sites de fixation du magnésium déduits de ces données ont permis de décrire l’ensemble des liaisons de coordination qui s’établissent entre les deux ions métalliques et leurs ligands ARN et qui promeuvent la catalyse de l'épissage inverse.
Un aspect essentiel révélé par les présentes structures cristallographiques est l’existence de deux réarrangements structuraux locaux nécessaires à la mise en place d’un site actif fonctionnel. Un de ces réarrangements consiste en un remaniement des appariements base-base de l’hélice du domaine VI, ce qui permet de positionner la branche 2’-5’ dans le site actif. Le second réarrangement est induit par la fixation de l’exon 5’ à l’intron ‘lasso’ et contribue de façon déterminante à la coordination d’un des deux ions métalliques catalytiques.
Enfin, ces structures cimentent le lien évolutif entre les introns de groupe II et le système d’épissage des pré-messagers eucaryotes, car elles suggèrent des homologies fonctionnelles précises entre nucléotides conservés dans les deux systèmes.
À ce jour, des vecteurs dérivés des rétro-transposons de groupe II et dédiés à la manipulation du génome sont déjà couramment utilisés chez les bactéries. Les connaissances tirées de ces travaux permettront la conception rationnelle de nouveaux vecteurs avec des propriétés modifiées ou inédites susceptibles, entre autres, d’élargir le champ d’application de ces molécules à potentiel thérapeutique aux génomes eucaryotes.