Entrée du virus de la stomatite vésiculaire dans les cellules hôtes : Deux nouvelles structures moléculaires résolues
Le virus de la stomatite vésiculaire (VSV) est un virus enveloppé qui peut infecter les insectes, les bovins, les chevaux et les porcs. Chez les mammifères, sa capacité à infecter et tuer les cellules tumorales, tout en épargnant les cellules normales, en fait un virus oncolytique prometteur pour le traitement du cancer. Sa membrane contient une unique glycoprotéine (G) qui joue un rôle majeur lors des premières étapes de l’infection.
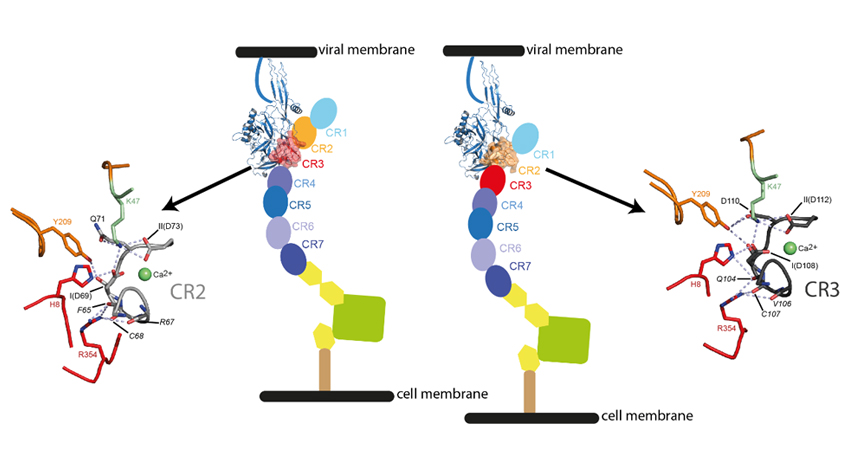
Des chercheurs du Département de Virologie de l’I2BC et de la ligne PROXIMA-1 ont obtenu les structures 3D de G en complexe avec deux domaines protéiques d’un des récepteurs du VSV.
La glycoprotéine G du VSV reconnait tout d’abord les récepteurs à la surface de la cellule hôte puis, après endocytose du virus, elle catalyse la fusion des membranes virale et endosomale, ce qui permet la libération de la nucléocapside virale dans le cytosol pour les étapes ultérieures de l’infection.
Il avait été montré que le récepteur des lipoprotéines de basse densité1 (LDL-R) et d’autres récepteurs de la même famille étaient des récepteurs du VSV. Des chercheurs du Département de Virologie de l’I2BC et de la ligne PROXIMA-1 viennent d’obtenir les structures de G en complexe avec deux domaines CR (pour Cystein rich) du LDL-R qui en contient sept. Les deux domaines occupent le même site de liaison. Deux acides aminés de G, essentiels pour la liaison des domaines CR, ont été identifiés : leur mutation abolit la capacité de G à lier son récepteur sans toutefois abolir ses propriétés de fusion virale. De façon remarquable, des virus pseudotypés2 avec de tels mutants de G ne sont plus infectieux.
Ce travail montre que G a évolué de façon à reconnaitre de façon spécifique les domaines CR présents dans les récepteurs de la famille du LDL-R et que les seuls récepteurs viraux appartiennent à celle-ci.
Sachant que VSV est un virus oncolytique et que G est la glycoprotéine la plus utilisée à des fins de vectorisation, ce travail ouvre de nombreuses perspectives en biotechnologie médicale. En effet, la possibilité de découpler la reconnaissance du récepteur et les propriétés de fusion virale permettent d’envisager la construction de glycoprotéines, ciblant d’autres récepteurs, qui pourront être par exemple utilisées pour pseudotyper des rétrovirus ou pour construire des VSV ayant un tropisme modifié.
- Les Lipoprotéines de basse densité, ou LDL en anglais, sont des protéines dont la fonction est de transporter les lipides dans le sang, notamment le cholestérol, vers les cellules.
- virus pseudotypé : virus combiné à une protéine d'enveloppe étrangère, qui confère alors au virus un tropisme ou une stabilité différente.