Eclairage nouveau sur une enzyme cruciale pour les processus biologiques
Des chercheurs de l'Université de Liverpool ont révélé la structure cristalline d'une enzyme bactérienne, ce qui permettra de mieux comprendre la manière dont les électrons passent d'une protéine à une autre dans les organismes. Leurs résultats, obtenus notamment par des expériences de diffraction de rayons X sur la ligne de lumière PROXIMA 1, sont publiés dans la revue Nature.
Le mouvement des électrons, nommé transfert électronique, est essentiel pour tous les organismes vivants car il est à la base de processus tels que la respiration, la photosynthèse et la détoxification.
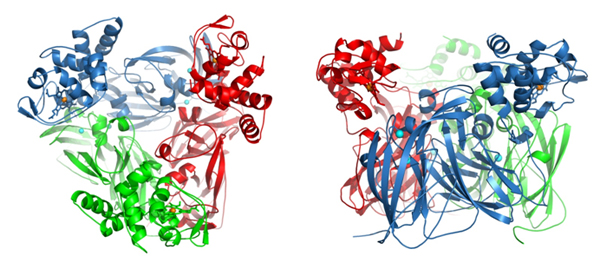
Des chercheurs de Liverpool ont examiné la structure d'un complexe naturel entre le noyau d’une enzyme, la nitrite réductase, et un domaine donneur d'électrons. Ces travaux apportent un éclairage nouveau sur le rôle que cette structure joue dans le transfert électronique et dans la production d'oxyde nitrique, un précurseur direct de l'oxyde nitreux. Ce dernier est un gaz à la fois nocif pour la couche d'ozone et contribuant à l’effet de serre : son coefficient de transfert radiatif1 est 300 fois plus élevé que celui du CO2.
Le Dr Svetlana Antonyuk, de l'Institute of Integrative Biology de l'université, explique : « Le transfert d'électrons entre protéines partenaires est un phénomène clé dans le fonctionnement de tous les organismes vivants, mais notre compréhension en est limitée. »
« Les complexes de protéines ont un caractère très transitoire dans la nature, c’est pourquoi il est difficile d’en obtenir des cristaux ; or c’est sur les cristaux qu’il est possible d’appliquer la puissante méthode qu'est la cristallographie, permettant d’obtenir une image des protéines. Notre système offre un avantage majeur car les protéines donneur et accepteur d’électrons sont naturellement fusionnées. »
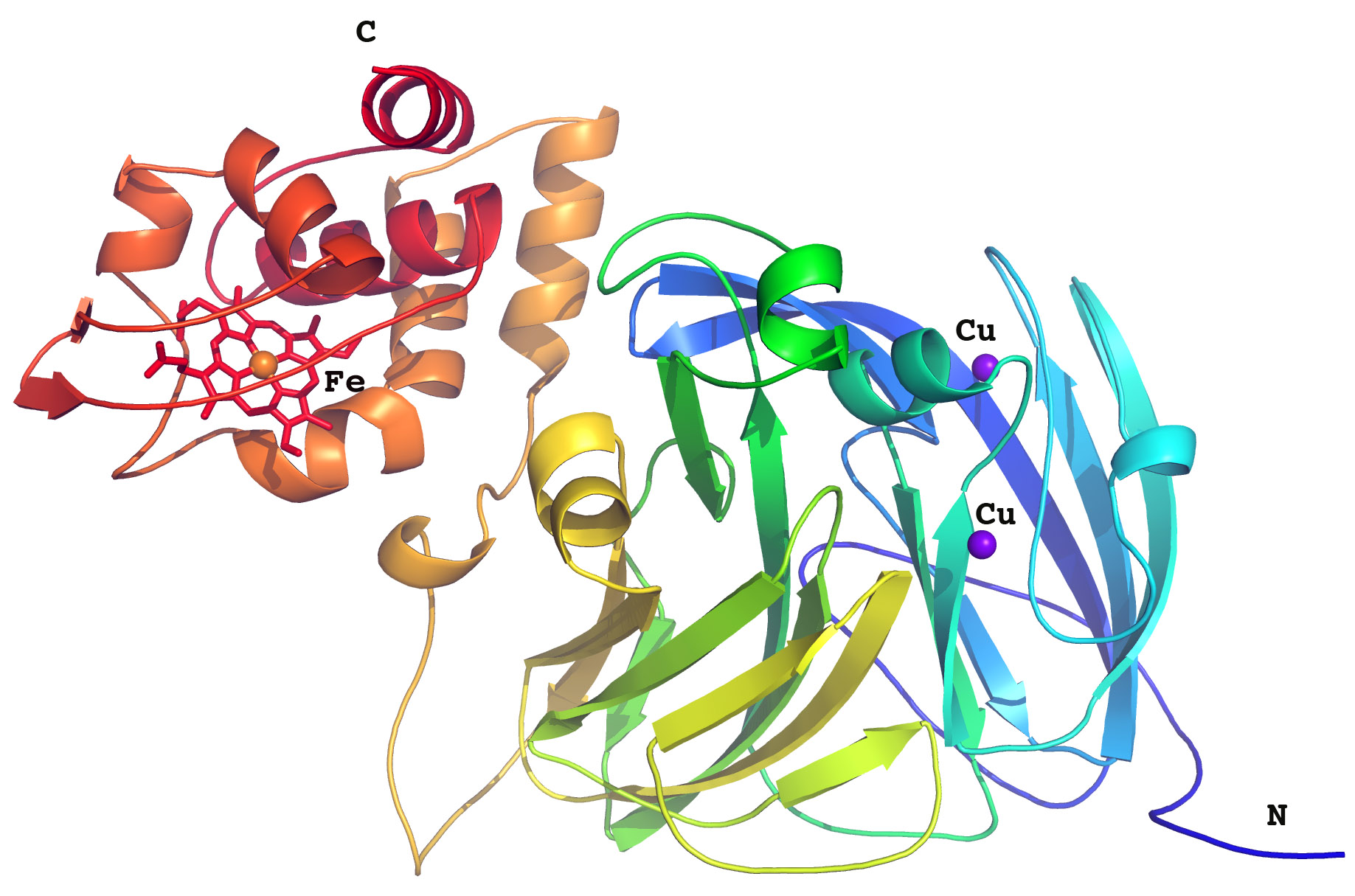
Dr Antonyuk et ses collègues ont travaillé sur une nitrite réductase bactérienne, RpNiR, qui est particulièrement intéressante car elle combine deux partenaires redox en une même enzyme : un domaine cytochrome et un domaine réductase.
Dr Antonyuk : « Une caractéristique marquante de la structure étudiée est son réseau aqueux étendu. Plusieurs études avaient suggéré l'importance des molécules d'eau dans la médiation des transferts électroniques, mais nos travaux l'ont démontré. »
« Pour ces recherches, nous avons utilisé plusieurs des sources de rayonnement synchrotron X les plus intenses, telles que les synchrotrons Diamond et SOLEIL [Sur PROXIMA 1, les auteurs ont obtenu des données pour l'enzyme RpNiR à l'état natif sous deux formes cristallines]. L'utilisation de ces installations de pointe a été capitale pour obtenir la haute résolution des structures de ce complexe lié et être en mesure de voir chaque atome de la molécule. »
Prof. Samar Hasnain, co-auteur de la publication Nature, ajoute : « L'ouverture de SOLEIL aux utilisateurs internationaux dès sa création a beaucoup aidé une grande partie de la communauté à relever des défis en biologie structurale. »
Le Dr Antonyk conclut : « Nos découvertes apporteront des révélations importantes sur les processus biologiques. »
L'accès aux lignes de lumière SOLEIL (pour des projets européens d'excellence en sciences de la Vie) est facilité par le projet FP7 BioSTRUCT-X de la Commission européenne. La date limite du prochain appel à projets est le 30 avril 2013.
1 - Coefficient de transfert radiatif : les gaz à effet de serre ont un impact sur le réchauffement climatique à cause de leur capacité à renvoyer vers le sol une partie de la chaleur (IR) émise par la surface de la Terre, après qu’elle ait été chauffée par le Soleil. On a arbitrairement attribué au CO2 un coefficient de 1. Le coefficient des autres gaz est calculé en comparant les effets d’une masse donnée de gaz à ceux provoqués par la même masse de CO2. Un gaz va avoir un coefficient de 2 si son impact est deux fois plus important que celui du CO2, etc.
Ces travaux sont financés par le Biotechnology and Biological Science Research Council (BBSRC).