Des virus de bactéries avec un alphabet génétique élargi
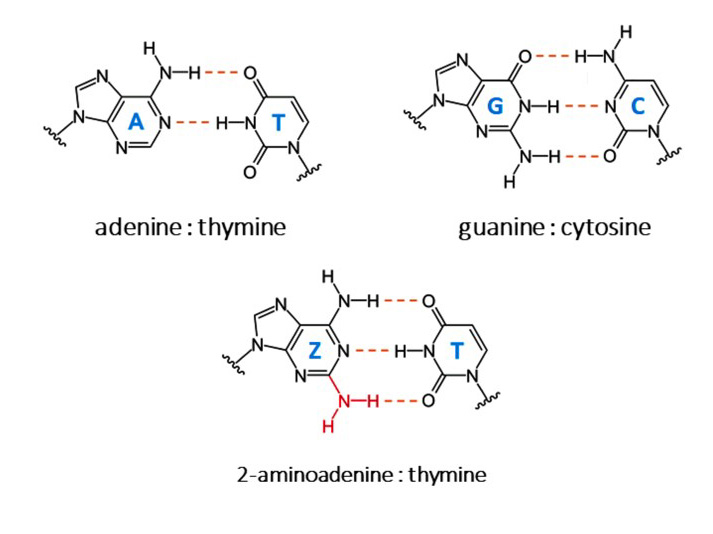
Chez tous les organismes vivants, l’ADN génomique est composé de 4 bases nucléotidiques : A, T, C et G : adénine, thymine, cytosine et guanine. Tous, sauf chez certains bactériophages (virus qui infectent des bactéries) dont l’ADN est composé des 4 bases ZCGT ; l’adénine est remplacée par la diaminopurine, notée Z qui, comme l'adénine, se lie à la thymine, mais en formant avec elle 3 liaisons hydrogène au lieu de 2.
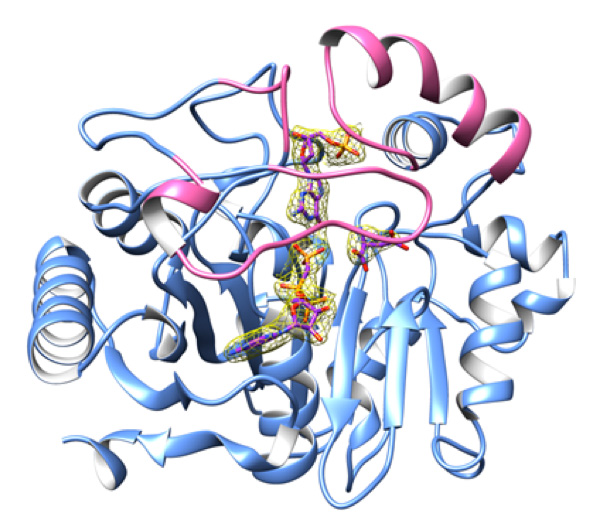
La structure tridimensionnelle de la protéine PurZ, enzyme qui permet la synthèse de cette base Z, vient d'être résolue grâce aux données de diffraction X collectées sur les lignes de lumière PROXIMA-1 et PROXIMA-2A.
Les résultats sont publiés dans la revue Science.
Le premier génome ZCGT avait été mis en évidence en 1977 par des scientifiques russes chez le bactériophage S-2L qui infecte une cyanobactérie. Ce cas est resté unique durant de nombreuses années - depuis, plusieurs autres bactériophages contenant un génome ZCGT ont été identifiés.
Le séquençage du génome de S-2L à l’Institut Pasteur en 1998 a permis d’identifier un gène codant une protéine, appelée PurZ, présentant des homologies avec la protéine bien connue PurA, ou adénylosuccinate synthase. Or, PurA est l’enzyme qui catalyse la première réaction de formation de la base A. D’où l’hypothèse que la protéine PurZ pourrait être responsable de la première étape de la biosynthèse de la base Z.
La résolution de la structure 3D de la protéine PurZ, seule et en complexe avec les molécules nécessaires à la première étape de la synthèse de la base Z (dGMP, AMPPcP et aspartate dans la figure 2) et produits de la réaction a été possible grâce aux données de diffraction des rayons X collectées sur les deux lignes de bio-cristallographie de SOLEIL, PROXIMA-1 et PROXIMA-2A.
Une analyse phylogénétique de cette famille d'enzymes a révélé un lien entre PurZ et l'enzyme PurA des archées. Cela indique que PurZ est une enzyme ancienne qui a probablement conféré un avantage évolutif aux différents bactériophages possédant un génome ZCGT.
La nouvelle paire de bases Z-T et la découverte de la voie de biosynthèse montrent que de nouvelles bases peuvent être incorporées par voie enzymatique dans le matériel génétique. Cela augmente le nombre de bases codantes dans l'ADN, ouvrant la voie au développement de biopolymères génétiques synthétiques.