Des protéines faciles à éplucher… en électrons !
Arracher des électrons à la matière requiert de l’énergie qui peut être apportée sous diverses formes. Lorsqu’on utilise la lumière comme source d’énergie, il s’agit de l’effet photoélectrique, par lequel des électrons de la matière neutre (atomes, molécules) sont éjectés par photo-ionisation. Lorsque les cibles de départ sont des ions chargés négativement, on parle de photodétachement, un processus qui requiert des énergies modestes (inférieures à quelques eV) car l’attraction coulombienne ressentie par l’électron sortant est moins élevée dans ce cas que si l’électron est éjecté à partir de matière neutre.
Cela explique que ce processus de photo-détachement ait, dans le passé, été très largement étudié avec des lasers visible et UV proche, dont l’énergie est suffisante pour induire le photodétachement. Mais très peu d’études ont porté sur le domaine du VUV (UV très lointain) de plus haute énergie. Comment la matière chargée négativement au départ (anions) allait-elle se comporter face à cette irradiation VUV ?
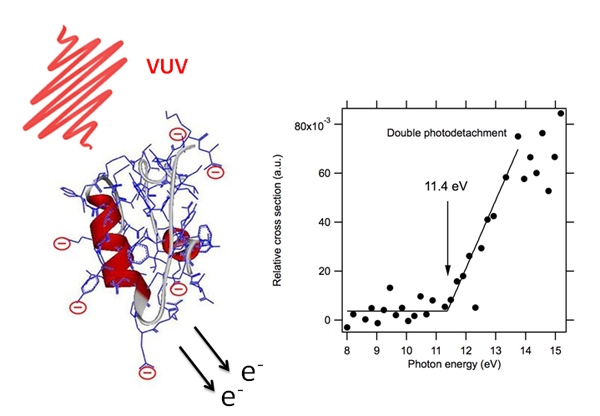
Grâce à la mise au point à SOLEIL du couplage innovant entre le rayonnement synchrotron dans le VUV et la spectrométrie de masse, des chercheurs de l’Université Claude Bernard de Lyon-CNRS et de SOLEIL, ont montré que le photodétachement d’électrons était le mécanisme principalement observé suite à l’irradiation avec des photons VUV (de 6 à 20 eV) sur des protéines modèles, telles que l’insuline, multichargées négativement (polyanions, voir Figure 1), et ce quel que soit l’état de charge de l’anion de départ. Si les temps d’irradiation sont longs (plusieurs centaines de millisecondes), la protéine peut même éjecter séquentiellement plusieurs électrons : on assiste alors à un véritable épluchage de la protéine en électrons !
Plus spectaculaire encore, cette étude a mis en évidence pour la première fois un double détachement direct d’électrons de valence dans ces protéines. Le double photo-détachement séquentiel (essentiellement par relaxation Auger) en couche interne avait déjà été reporté (en utilisant des techniques de faisceaux d’ions et du rayonnement synchrotron) sur des atomes et petites molécules. Ici, le seuil pour l'éjection directe des deux électrons est mesuré à 11,4 eV (voir figure 1), seuil bien inférieur à ceux mesurés pour le double photo-détachement en couche interne.
Ce double photo-détachement direct, signature de fortes corrélations électronique au sein de la protéine, semble être un mécanisme de relaxation qui mène à des anions oxydés qui gardent la structure de la protéine anions de départ, une caractéristique de grande importance en radiobiologie. En effet, une observation frappante sur les spectres de masse enregistrés est la grande stabilité de la protéine oxydée (avec très peu de fragmentation) sur l'échelle de temps de l'expérience, même dans le cas de photo-détachements multiples.
Cette découverte ouvre également des perspectives de recherche fondamentale extrêmement riches. Notamment, la corrélation de l'énergie entre les deux électrons émis et la structure électronique exacte de l'ion produit devra être étudiée en détail dans le futur pour comprendre à la fois la dynamique du processus et ses implications en termes de structure. Il s’agira en effet de comprendre comment l’énergie déposée dans le système se répartit entre les différents degrés de libertés électroniques (énergie des deux photoélectrons émis) et nucléaire, pouvant conduire ou pas vers la fragmentation de la molécule.
Référence :
Antoine, R. & Dugourd, P. Phys. Chem. Chem. Phys. (2011) 13,16494.