Des nanotubes d'argile photoactifs pour produire de l'hydrogène
La photocatalyse1 est considérée comme l'une des technologies les moins chères et les plus efficaces pour résoudre le problème de la pénurie mondiale d'énergie. L'un des défis consiste à trouver le bon matériau photoactif pour un processus efficace. Les nanotubes d'argile suscitent un regain d'intérêt en raison de leurs propriétés physiques uniques et de la possibilité de doper leur structure pour améliorer la séparation des porteurs de charge dans leur structure. Dans le cadre d'un consortium international, des chercheurs du Laboratoire de Physique des Solides (CNRS/UPSaclay) ont démontré une avancée dans la production photocatalytique d'H2, grâce au dopage de nanotubes d'argile.
En quoi les principes chimiques et/ou physiques fondamentaux diffèrent-ils lorsque les systèmes photocatalytiques sont limités à des dimensions nanométriques ? L'essor des nanosciences et des nanotechnologies offre un terrain de jeu idéal pour explorer ces concepts, des nanotubes aux architectures poreuses 3D plus complexes. En particulier, les nanotubes synthétiques d’imogolite de formule chimique (OH)3Al2O3Ge(OH) apparaissent comme des matériaux photocatalytiques prometteurs. L’intérêt des scientifiques pour ces nanotubes d’argile provient de calculs ab initio prédisant une séparation spatiale atypique des seuils des bandes de valence et de conduction2 à travers les parois des nanotubes, ce qui favoriserait les réactions d'oxydoréduction dans des parties distinctes du nanotube. Cependant, leurs larges bandes interdites2 ont empêché leur utilisation comme photocatalyseurs jusqu’à ce jour.
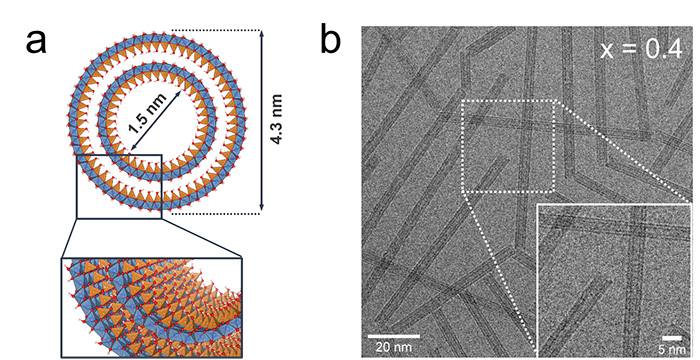
La première étape vers l'utilisation de ces nanotubes en photocatalyse et l'exploitation de la séparation des charges favorisée par la polarisation à travers leurs parois consiste à réduire leur bande interdite. Un consortium international dirigé par des chercheurs du Laboratoire de Physique des Solides d’Orsay a étudié le potentiel des nanotubes d'imogolite synthétiques à double paroi (figure 1a) pour des applications photocatalytiques. Dans le but de transformer l'imogolite, matériau non photo-actif, en un photocatalyseur efficace pour la génération de H2, les scientifiques ont substitué une partie des atomes de Ge contenus dans les molécules composant les nanotubes par des atomes de Ti (dopage). Divers échantillons Ti/Ge sont préparés en modifiant le rapport initial des précurseurs3 x = [Ti]/([Ge]+[Ti]). Les études morphologiques par diffusion des rayons X et par cryo-microscopie électronique à transmission conventionnelle révèlent la préservation de la forme du nanotube jusqu'à x = 0,4 (figure 1b).
(a) Vue schématique d'une structure de nanotube d’imogolite à double paroi (DWINT, en anglais) avec des atomes Al, Ge et O représentés en bleu, orange et rouge, respectivement.
(b) Images de cryo-microscopie électronique à transmission d'échantillons Ti/Ge synthétisés avec un rapport de dopage x = 0,4.
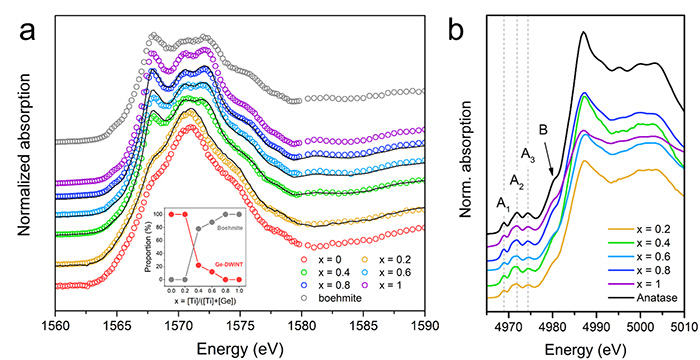
La compréhension des modifications structurales locales des nanotubes est essentielle pour une étude plus approfondie des propriétés photoinduites de ces nanostructures dopées. Pour confirmer la modification induite par le dopage, une caractérisation multi-échelle a été réalisée en combinant différentes spectroscopies de rayons X et en particulier la spectroscopie d'absorption XANES sur la ligne de lumière LUCIA. Le XANES au seuil K de l'Aluminium révèle une large bande d'absorption située à 1571 eV, caractéristique de l'Al dans une configuration octaédrique (Figure 2a). Une résonance de plus faible énergie apparaît à 1567 eV avec l'augmentation du rapport de précurseur, ce qui est lié à la présence d'un sous-produit, de la boehmite d'Aluminium (oxyhydroxyde d’aluminium AlO(OH)), comme l'a démontré l'ajustement par combinaison linéaire des spectres XANES. Les spectres XANES au seuil K du Ti présentent les modes caractéristiques du pré-seuil attribués aux transitions dipolaires 1s à 3d du Ti4+ en configuration octaédrique. Ces résultats indiquent que les atomes de Ti semblent remplacer préférentiellement les atomes d'Aluminium.
(a) Seuil K de l'Al. Les courbes noires correspondent à l'ajustement de la combinaison linéaire en utilisant x = 0 et x = 1 comme références. La proportion résultante est affichée dans l'encadré.
(b) Seuil K du Ti.
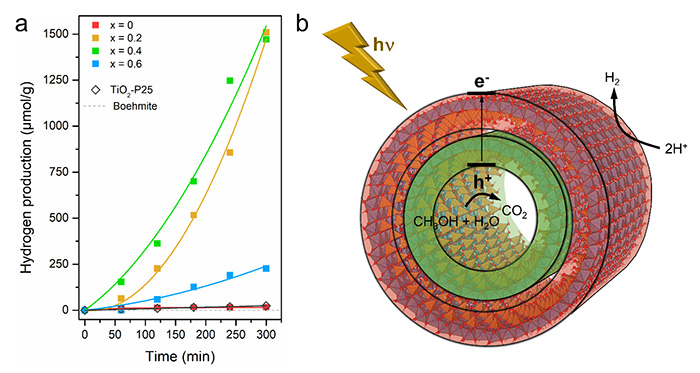
L'incorporation de Ti dans les nanotubes modifie suffisamment sa structure de bande pour conférer aux nanotubes des propriétés photocatalytiques uniques. L'efficacité photocatalytique révèle une production élevée d'hydrogène de ~1500 µmol. g-1 pour ce photocatalyseur sans métal noble, 65 fois plus élevée que le TiO2-P25 commercial (figure 3a) dans des conditions similaires de craquage de l’eau en présence d’un donneur d’électrons. Ceci est corrélé, pour les structures les plus actives, à une diminution du taux de recombinaison des porteurs de charge photogénérés. Au lieu d'utiliser un co-catalyseur métallique comme site de réduction et collecteur d'électrons, la polarisation naturelle des nanotubes dopés au Ti facilite la séparation des charges photogénérées, rendant les sites de réduction et d'oxydation spatialement séparés, comme l'illustre la figure 3b. Les charges photogénérées induisent l'adsorption dissociative du méthanol, utilisé comme donneur d'électrons, et le piégeage des trous, qui est suivi par la libération d'ions hydrogène. La réduction conduisant à la formation d'une molécule de H2 devrait être localisée à la surface extérieure des nanotubes, tandis que l'oxydation a lieu dans les nanotubes (figure 3b).
(a) Réaction d'évolution de l'hydrogène sous irradiation solaire pour les échantillons de nanotubes contenant du Ge (Ge-DWINT) ou différents rapports Ti/Ge, et comparaison avec des standards internes.
(b) Illustration schématique du mécanisme de production de H2 proposé, indiquant les étapes générales impliquant la séparation des charges électrons/trous et les voies de réaction.
Ces résultats confirment les prédictions théoriques concernant le potentiel des nanotubes d'imogolite modifiés en tant que nanoréacteurs photoactifs et ouvrent la voie à l'étude et à l'exploitation de leurs propriétés de polarisation pour des applications énergétiques.
-----------------------------
1 - La photocatalyse est un phénomène dans lequel un matériau "photocatalyseur" accélère la vitesse d'une réaction chimique sous l'action de la lumière, naturelle ou artificielle.
2 – bande de valence/ de conduction/ interdite : l’énergie des électrons d’un solide peut avoir n'importe quelle valeur à l'intérieur de certains intervalles, appelés « bandes permises », séparées par des « bandes interdites ». Dans un isolant, une large bande interdite sépare bande de valence -dans laquelle les électrons ne participent pas à la conduction électrique- et bande de conduction (électrique). Dans un conducteur (métal), bandes de valence et de conduction se chevauchent : les électrons de la bande de valence peuvent passer dans la bande de conduction et circuler dans le solide. Dans un semi-conducteur la bande interdite est fine : des électrons de la bande de valence peuvent passer dans la bande de conduction si on leur apporte un peu d’énergie (électricité, lumière). Il est aussi possible de contrôler ce passage vers la bande de conduction (donc la conductivité du matériau) par dopage.
2 - Précurseur : molécule composant le nanotube ; ici plusieurs précurseurs, contenant différentes proportions d’atomes de Ge et de Ti, ont été testés.