Des matériaux simples et abondants pour une énergie future propre et efficace
L’utilisation de l’hydrogène H2 comme vecteur d’énergie propre est l’un des axes technologiquement viables aujourd’hui1. L’hydrogène peut être produit par photoélectrolyse de l’eau : une réaction d’électrolyse utilisant des électrodes activées par la lumière solaire. L’hématite, très abondante sur Terre, est un matériau photosensible permettant de fabriquer des anodes pour ce type de réaction.
Par des méthodes simples, comme le recuit sous atmosphère contrôlée d’azote, des scientifiques du SPEC, de la ligne HERMES et de l’ICPMS ont réussi à améliorer la production d’hydrogène par les photoanodes à base d’hématite. Les instruments de mesure de pointe de la ligne de lumière HERMES permettent de comprendre l’origine de cette amélioration et ouvrent la voie vers des approches simples, abordables et efficaces, visant l’optimisation des matériaux pour les cellules de photoélectrolyse de demain.
L’hématite, Fe2O3, peut être employée pour la production d’hydrogène par dissociation de l’eau, dans une réaction de photoélectrolyse. En effet, une bonne partie de l’énergie consommée dans un électrolyseur2 peut être substituée par l’absorption directe de la radiation solaire en utilisant des anodes photosensibles, comme l’hématite. La bande interdite de cet oxyde semiconducteur est de 2,1 eV, correspondant à l’énergie de la lumière solaire visible. Lors de l’absorption de cette lumière, une paire électron-trou est générée dans l’hématite : l’électron réduira l’eau à la cathode (HER), tandis que le trou oxydera l’eau à l’anode (OER). Le photocourant ainsi généré est proportionnel à la quantité de molécules de H2 produites. Il devrait atteindre en théorie 12 mA/cm2 pour un potentiel de 1,23 V. En pratique, le photocourant ne dépasse pas quelques centaines de µA. Le responsable principal est le libre parcours moyen3 des trous qui est extrêmement réduit dans l’hématite, de l’ordre de 2 à 4 nm. Pour franchir cet obstacle, diverses techniques d’ingénierie de bandes électroniques sont employées, plus ou moins complexes, toutes visant à modifier les propriétés électroniques de l’hématite.
Dans le cadre d’une étude commune, des scientifiques du Service de Physique sur l’État Condensé (SPEC : UMR CEA – CNRS) à l’Orme des Merisiers, de l’Institut de Physique et Chimie des Matériaux de Strasbourg (IPCMS : UMR CNRS – Université de Strasbourg) et de la ligne HERMES de SOLEIL, ont déterminé l’origine de l’amélioration des performances des photoanodes à base d’hématite dopées avec du Ti, synthétisées sous atmosphère contrôlée d’azote. La synthèse se fait en 2 étapes : la première permet d’obtenir de l’akaganéite, Fe3+O(OH,Cl) dopée au Ti, sous forme d’un tapis constitué de nanobâtonnets sur des substrats de FTO4 par croissance chimique en phase aqueuse suivant un processus hydrothermal.
Pendant la 2ème phase, les échantillons sont recuits à 600 °C menant à une transformation de phase vers l’hématite. C’est le contrôle de l’atmosphère de recuit (air ou azote) lors de cette 2ème étape qui permet une amélioration des performances.
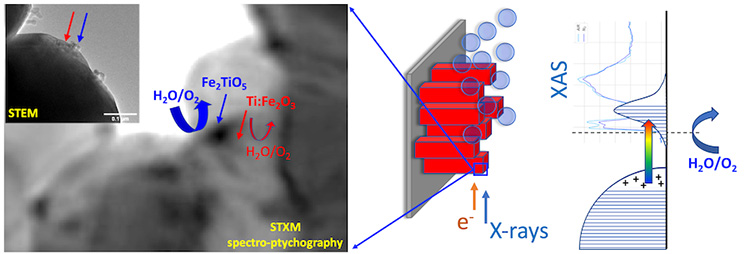
Cette étude se démarque notamment par l’utilisation complémentaire de l’ensemble de méthodes expérimentales disponibles sur la ligne HERMES. Le XPEEM (microscopie X de photoémission d’électrons), en détectant uniquement les électrons qui proviennent des couches atomiques les plus en surface du matériau analysé, permet de séparer les informations liées à la composition et à la coordination chimique provenant de cette surface de celles provenant du volume des échantillons. Pour cela les chercheurs ont mis à profit une approche détournée liée à la géométrie spécifique du microscope XPEEM : la « shadow XPEEM ».
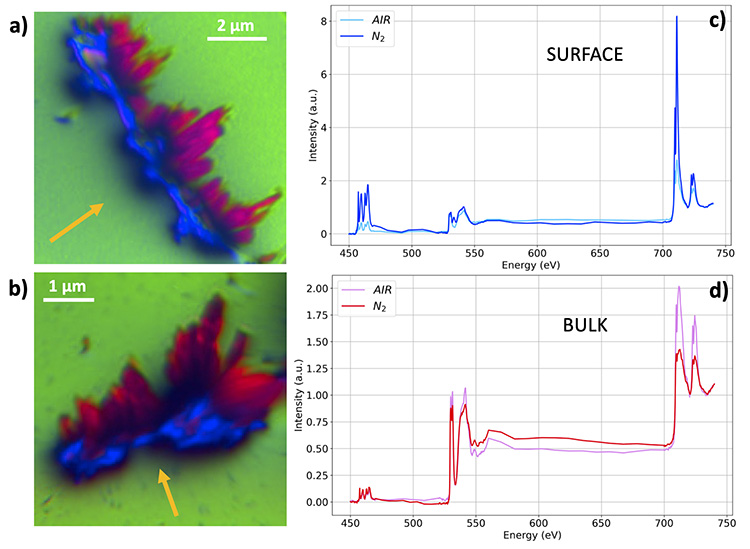
Les résultats montrent, dans le cas de l’hématite dopée Ti recuite sous atmosphère d’azote, la ségrégation en surface d’une phase riche en Ti et la formation des nouveaux états électroniques correspondant à des états de surface (Figure 1).
La microscopie X par transmission à balayage (en anglais « Scanning transmission X-ray microscopy » STXM) a été utilisée en complément des mesures XPEEM pour préciser la localisation spatiale de cette phase riche en Ti, en permettant de sonder sur des épaisseurs de matériau allant jusqu’à quelques centaines de nanomètres. Il a été possible de mettre en évidence des régions de quelques dizaines de nanomètres dont la signature spectrale différente de celle de l’hématite dopée Ti démontre la présence d’une coordination chimique spécifique à une phase de type pseudo-brookite (Fe2TiO5 ou FeTi2O5).
La spectro-ptychographie a quant à elle permis d’atteindre des meilleures résolutions et de localiser plus précisément les clusters de pseudo-brookite. La sensibilité de l’approche est remarquable : elle permet de différencier 2 phases contenant du Ti et présentant un décalage en énergie de seulement ~0.1 eV pour le pic à 457,5 eV (voir Film). C’est la démonstration directe de la puissance des méthodes spectro-microscopiques, un cas d’école où la sensibilité à la coordination chimique permet d’améliorer la résolution spatiale.L’étude montre qu’en jouant sur l’atmosphère de recuit, un paramètre physico-chimique simple, il est possible d’ajuster finement l’interface hématite/électrolyte à échelle nanométrique pour une amélioration nette de l’activité lors du processus de dissociation de l’eau.
[[{"fid":"15472","view_mode":"teaser","fields":{"format":"teaser"},"link_text":null,"type":"media","field_deltas":{"7":{"format":"teaser"}},"attributes":{"class":"media-element file-teaser","data-delta":"7"}}]]
Film : Résultat hyperspectral en mode transmission de spectro-ptychographie obtenu au seuil d’absorption de Ti (1ère partie du film, spectres 456,5-468,5 eV) et O (2ème partie, spectres 529-535 eV). Grâce à la forte sensibilité spectrale de cette technique, les clusters de pseudo-brookite apparaissent très contrastés au maximum de leur absorption (partie « surface », à 457,5 eV). Taille de l'image : 2,5 x 2,5 µm2.
---------------------------------------------
1 - https://www.economie.gouv.fr/industrie-nouvelle-strategie-hydrogene-pour-la-france
2 - Un électrolyseur permet de dissocier l’eau utilisant deux électrodes métalliques, l’anode et la cathode, en appliquant une différence de potentiel plus élevée que le niveau redox de l’eau, de 1,23 V. De cette manière de l’oxygène est généré à l’anode et de l’hydrogène à la cathode.
3 - Libre parcours moyen : distance sur laquelle une charge peut se déplacer sans subir une recombinaison.
4 - FTO : oxyde d’étain dopé avec du Fluor. C’est le substrat de choix pour toutes les applications solaires.