De l’acide nitrique sur les flocons de neige…
L'acide nitrique HNO3 est un acteur important dans un grand nombre de processus environnementaux hétérogènes mettant en jeu des aérosols atmosphériques, des particules glacées en suspension et de la neige. Savoir si l'acide nitrique est adsorbé sous sa forme moléculaire HNO3 ou sous sa forme dissociée NO3- (nitrate) sur ces surfaces environnementales a une importance clé pour la formation, la stabilité et la réactivité des nitrates dans la matière particulaire urbaine, dans la formation et la durée de vie des cirrus, et dans le budget des oxydes d'azote atmosphériques au-dessus des régions couvertes de neige.
Sur la ligne TEMPO, des équipes françaises et canadiennes ont étudié par spectroscopie d’absorption X (XANES) la conversion de l'acide nitrique en nitrate sur la glace d'eau, en fonction de la température de la glace.
La quantité de nitrites et nitrates (NOx) atmosphériques libérée par la photolyse UV-visible du HNO3 moléculaire piégé dans le manteau neigeux serait 400 % plus élevée que celle du NO3-, ce qui signifie que l'existence d'une forme moléculaire stabilisée de HNO3 dans la glace d'eau aurait un impact énorme sur les flux de NOx au-dessus de la cryosphère terrestre. Il n'existe à l'heure actuelle aucune réponse satisfaisante à la question d'une éventuelle dissociation de HNO3 dans/sur la glace d'eau, ce qui a motivé la caractérisation de la forme chimique du HNO3 adsorbé sur de la glace en utilisant la spectroscopie XANES sur TEMPO.
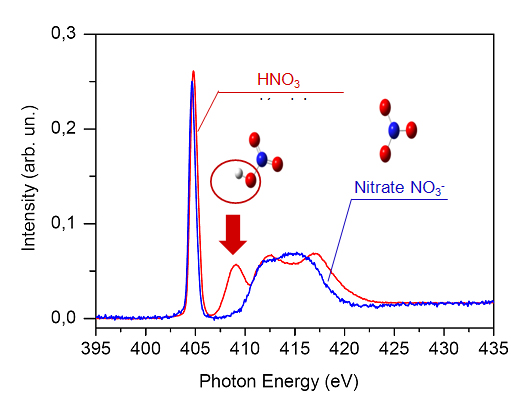
Les structures électroniques de HNO3 et de NO3- étant différentes, les spectres XANES de ces espèces sont aussi susceptibles d'être différents. C'est effectivement le cas (figure 1), notamment au voisinage de 409 eV où le spectre moléculaire de HNO3 (en rouge) présente une forte résonance (indiquée par une flèche) spécifique au groupe hydroxyle OH, qui est absente dans le cas de NO3- (en bleu). Ainsi, il est particulièrement facile d'étudier la conversion de l'acide nitrique HNO3 en nitrate NO3- sur la glace d'eau grâce à cette forme spectrale à 409 eV.
Cent monocouches pour un flocon
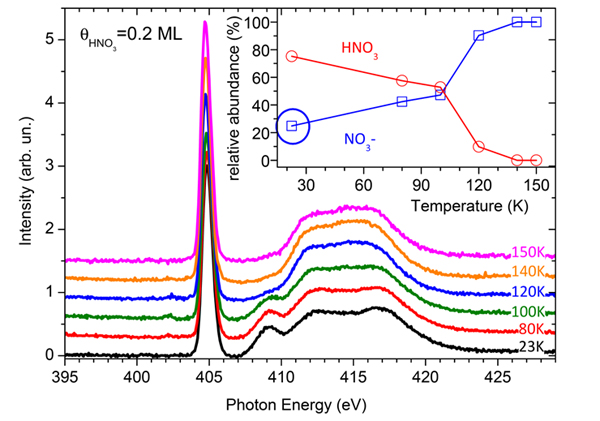
Les chercheurs ont étudié le degré d'ionisation du HNO3 à la surface d'une couche mince de glace d'eau (épaisse de 100 monocouches), une configuration utilisée comme modèle de l'interaction d'un flocon de neige avec l'acide nitrique. La figure 2 présente l'évolution du signal de seuil K de l'atome d'azote sur 0,2 monocouche de HNO3 adsorbée sur de la glace à 23 K, puis chauffée à 150 K. La disparition progressive de la résonance à 409 eV avec la température indique la conversion graduelle du HNO3 en NO3-. En ajustant les spectres XANES avec une combinaison linéaire des spectres HNO3 et NO3- présentés dans la figure 1, il est possible d’estimer l'abondance relative de ces deux espèces en fonction de la température (encart). Bien que le spectre à 23 K ressemble à celui du HNO3 pur, l'ajustement indique que déjà 25 % de l'acide nitrique sont convertis en NO3- (encart, cercle bleu).
Une conversion en nitrate facile
Ceci constitue un résultat très important montrant que la dissociation ionique du HNO3 à la surface de la glace pourrait se produire naturellement sans barrière d'activation, vraisemblablement lorsque HNO3 se trouve sur un site d'adsorption favorable, c'est-à-dire lorsque suffisamment de molécules d'eau peuvent dissocier HNO3 et solvater l'anion nitrate. Le reste du HNO3 est moléculaire et correspond à des molécules se trouvant sur d'autres sites de surface qui ne possèdent pas de telles capacités. Ces molécules sont progressivement converties en NO3- lorsque la température de la surface augmente, ce qui fournit l'énergie nécessaire à l'optimisation de la couche de solvatation et ainsi à la dissociation. Au voisinage de 110 K, l'augmentation brutale du taux de conversion est due à la diffusion des molécules d'acide nitrique dans le volume de la glace, où elles trouvent suffisamment de molécules d'eau pour subir l'ionisation et la solvatation.
Cette étude montre que l'ionisation de HNO3 se produit facilement à la surface de la glace, et que la diffusion de la molécule dans le volume réalise sa conversion intégrale en NO3-. Ceci indique que pour les processus atmosphériques mettant en jeu la réaction du HNO3 avec la surface d'hydrométéores atmosphériques ou de particules humides en suspension, on s'attend à ce que l'acide nitrique se comporte comme un acide fort aux températures atmosphériques typiques de la cryosphère terrestre (environ 250 K).
Toutefois, il serait intéressant de confirmer ce point à l'avenir, par exemple en utilisant la station expérimentale de spectroscopie de photoélectrons (XPS) fonctionnant à pression quasi-atmosphérique qui est actuellement en développement sur la ligne de lumière TEMPO.