Composés à valence mixte : TEMPO révèle le caractère divalent du sel d'europium hydraté en ultra-vide
Les applications utilisant des ions europium, et notamment Eu3+, connaissent un nouvel essor en photonique avec les diodes lumineuses organiques (OLED), les lasers, les communications optiques et en tant que marqueurs fluorescents dans les systèmes biologiques. Les ions Eu2+ ne possèdent pas les mêmes propriétés optiques et électroniques que les ions Eu3+. Des chercheurs du LPCML, de l’ICMR et du SPCSI ont utilisé la spectroscopie de photoémission sur TEMPO pour montrer que les sels d'EuCl3 contiennent les ions Eu3+ attendus, mais également une quantité non négligeable d’ions Eu2+, sous une forme stable sous vide.
Les ions lanthanides présentent de bonnes qualités photoniques telles que la pureté spectrale. L'ion europium, qui en fait partie, est utilisé depuis longtemps comme dopant dans les phosphores organiques (utilisés dans les tubes cathodiques notamment). Récemment, les ions lanthanides ont révélé un nouveau potentiel pour les qubits*. Toutefois, ils sont limités pour de telles applications en raison de leur haute sensibilité à l'environnement ionique et moléculaire, qui affecte leurs propriétés optiques.
La luminescence rouge très fine des ions Eu3+, semblable à une raie atomique, est à l'origine de l'intérêt que ces ions suscitent pour des applications. La lumière émise est principalement issue de la transition électronique à l'intérieur de la couche électronique 4f partiellement remplie. Au contraire, Eu2+ présente une bande d'émission large dans l'UV et dispose d'une faible efficacité quantique.
notable
Eu2+ ou Eu3+ ?
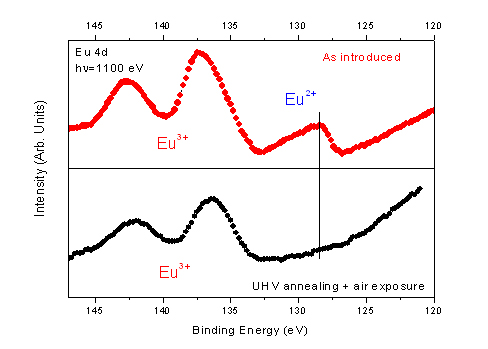
Bien que les sels d'EuCl3 hydratés soient des espèces bien caractérisées et stables, le dosage chimique des sels commerciaux a révélé une composition chimique inattendue avec une proportion d'un ion europium pour 2,85 contre-ions chlore. Cependant, la luminescence optique du sel mesuré dans l'air présente un spectre pur d'Eu3+. Pour attribuer les propriétés électroniques du sel d'europium hydraté, nous avons examiné la configuration électronique du niveau de cœur Eu 4d par photoémission. Le sel a été solubilisé dans de l'éthanol sec et déposé par évaporation de solvant sur un substrat d'or. De manière surprenante, le spectre de photoémission du niveau de cœur Eu 4d présente une composante singulière de forme asymétrique attribuée aux espèces Eu2+, ce qui indique une quantité significative d'europium Eu2+ (partie supérieure de la Fig. 1). L'ion europium est très sensible à la préparation de l'échantillon. En effet, le recuit de l'échantillon sous ultra-vide à une température supérieure à 350 °C, suivi d'une exposition à l'air, donne une espèce pure oxydée d'Eu3+ (partie inférieure de la Fig. 1).
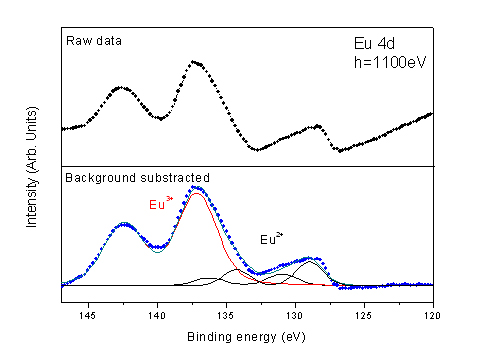
Par un ajustement de courbe sur le spectre du niveau de cœur Eu 4d, nous déterminons quantitativement le ratio Eu2+ sur Eu3+ (Fig. 2). En comparant les contributions des ions Eu2+ et Eu3+, nous constatons une proportion de 15-20 % d'Eu2+ dans le sel d'europium hydraté. Ce résultat est en bon accord avec le dosage chimique qui révèle une présence de 2,85 ions chlore pour un ion europium.
Cette étude a montré que le sel d'europium hydraté initial présente une phase stable sous vide, qui forme un composé hydraté de valence mixte EuCl2,85.
La compréhension de la structure électronique et de la stabilité chimique du sel d'europium dans l'air et sous ultra-vide est un facteur clé pour améliorer le traitement de matériaux similaires, et constitue un prérequis pour l'étude de systèmes plus complexes tels que les organométalliques. En effet les ions europium isolés présentent une section efficace d'absorption très faible dans l'ultraviolet. Pour surmonter cette limitation, l'ion europium doit être associé à un ligand organique jouant le rôle d'antenne et augmentant l'efficacité de l'absorption optique.
*Qubits : quantum bit, état quantique qui représente la plus petite unité de stockage d'information quantique.