Comment se forment les réserves de protéines dans un grain de blé ? Reconstitution in vitro du mécanisme, étudié sur DISCO
Lors du développement du grain de blé, les cellules du grain synthétisent des protéines de réserve, qui vont s’assembler en structures denses et sphériques appelées corpuscules protéiques. Ces corpuscules protéiques servent de réserves de carbone, de soufre et d'azote essentielles pour le développement de la plante au moment de sa germination. Malgré de nombreuses études, le mécanisme exact de formation de ces corpuscules protéiques reste encore méconnu.
Des scientifiques d’INRAE - Nantes se sont penchés sur cette question en utilisant, sur la ligne DISCO, une technique in vitro de microfluidique pour étudier la γ-gliadine, protéine de réserve clé chez le blé.
La formation des corpuscules protéiques a d’abord été attribuée à la précipitation spontanée des protéines de réserve du blé en raison de leur faible solubilité dans l’eau. Des études in vivo ont ensuite révélé que les corpuscules protéiques étaient des structures dynamiques qui fusionnent et échangent leur contenu. Des recherches in vitro ont montré que les protéines de réserve du blé peuvent subir une séparation de phases liquide-liquide, suggérant que ce processus pourrait être impliqué dans la formation des corps protéiques dès les premières étapes de la synthèse des protéines. Cependant, des incertitudes subsistent quant à la compatibilité de cette séparation de phases avec les conditions biologiques. De plus, la membrane du réticulum endoplasmique* pourrait jouer un rôle crucial en servant de point d’ancrage pour l’assemblage des protéines via des interactions protéines-membrane, notamment en raison de la forte affinité des gliadines (protéines de réserve essentielles du blé) pour les membranes lipidiques.
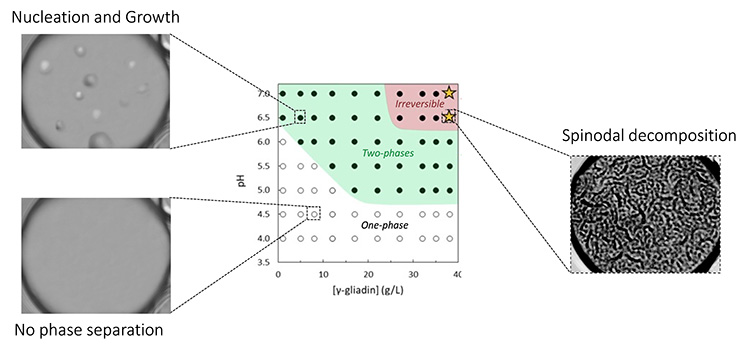
L’objectif de l’étude était d’étudier la séparation de phases liquide-liquide des gliadines de blé dans des conditions aqueuses proches des conditions biologiques et de caractériser une éventuelle compétition avec les interactions protéines-membranes. Pour cela, une approche microfluidique (figure 1) a été développée pour générer des vésicules lipidiques géantes et semi-perméables, sortes de microréacteurs à l’intérieur desquels il est possible de contrôler précisément les conditions physico-chimiques. Les scientifiques ont ainsi pu examiner l'influence du pH et de la concentration en gliadines sur ces vésicules, et les interactions entre gliadines et membrane des vésicules.
Dans ce but, sur la ligne de lumière DISCO la microscopie d'autofluorescence a été utilisée pour détecter la présence de protéines à la surface des membranes. En complément, la microscopie à contraste de phase, la microscopie confocale à balayage laser (CLSM) et la spectroscopie de fluorescence ont permis d’étudier la microstructure des assemblages protéiques en fonction du pH et de la concentration en gliadines.
Les scientifiques ont montré que les γ-gliadines encapsulées dans les vésicules peuvent subir une séparation de phases induite par le pH selon deux mécanismes distincts, en fonction de la concentration en protéines. À faible concentration, les γ-gliadines se séparent par un processus de nucléation et croissance, tandis qu'à des concentrations plus élevées, elles forment une phase bicontinue suggérant un mécanisme dit de décomposition spinodale (voir Figure 2). Dans toutes les conditions, les assemblages de γ-gliadines se localisent soit à la surface de la membrane et/ou se déposent au fond des vésicules.
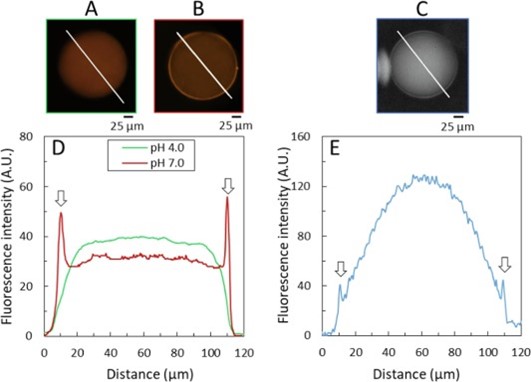
Pour étudier la microstructure et la localisation de la γ-gliadine dans les vésicules, des expériences ont été menées en CLSM. Des gliadines marquées avec un colorant fluorescent en lumière visible (couleur orange) ont été encapsulées dans des conditions de bonne solubilité (pH 4.0). En augmentant le pH à 7.0, une séparation de phase a été observée en colocalisation avec la membrane lipidique, suggérant une affinité des phases denses pour la membrane (Figure 3). La fluorescence intense observée à la surface des membranes était persistante même après retour au pH 4.0, suggérant une irréversibilité partielle de la séparation de phase.
En complément, des expériences de microscopie à autofluorescence UV sur DISCO ont été réalisées afin d’éviter l’utilisation de sonde fluorescente – en effet les gliadines fluorescent naturellement lorsqu’elles sont éclairées par de la lumière UV. Même dans des conditions de bonne solubilité, une couche fluorescente à l'interface des vésicules a alors été observée, suggérant, comme les résultats de CLSM, une adsorption de la γ-gliadine sur la membrane.
Ces nouvelles expériences permettent de mieux comprendre le contexte biologique de la formation des corpuscules protéiques dans le grain de blé. En particulier, l’étude confirme la survenue de la séparation de phases en présence de membranes lipidiques et en milieu aqueux. Le diagramme de phase établi montre une concentration de saturation très faible à pH 7,0, suggérant qu'une faible concentration locale pourrait suffire à générer des corpuscules protéiques de réserve pendant la synthèse des gliadines. Bien que la complexité biologique du développement des graines ne soit pas encore atteinte avec ce protocole expérimental, la séparation de phases reste une piste prometteuse pour comprendre la formation des corpuscules protéiques dans les graines.
* Reticulum endoplasmique : compartiment de la cellule, délimité par une membrane, dans lequel les protéines sont synthétisées.