Comment les monosaccharides sont-ils transportés à travers la membrane cellulaire ?
Une équipe suédoise donne des éclairages-clés grâce à une nouvelle structure 3D du transporteur de xylose XylE de E. coli, résolue à partir de données collectées sur PROXIMA1.
Des chercheurs du Karolinska Institutet de Stockholm ont obtenu, sur la ligne PROXIMA1, des données de diffraction qui leur ont permis de déterminer la structure du transporteur de xylose XylE, de Escherichia coli, dans une conformation ouverte vers l'intérieur. Ce résultat confirme l'hypothèse déjà ancienne de l'« accès alternatif » pour le mécanisme de transport de cette classe de protéines, et démontre que les deux domaines de la protéine se déplacent l'un par rapport à l'autre avec d’importants mouvements de corps rigides pendant le cycle fonctionnel. Ces résultats sont publiés dans la revue Nature Structural and Molecular Biology.
Faire traverser la membrane plasmique : la mission de MFS
Le transport sélectif d'ions et de petits composés organiques à travers la membrane plasmique est essentiel au maintien de l'homéostasie dans tous les types de cellules. Cette tâche est menée à bien par une grande quantité de protéines de canal et de transport. L'une des plus grandes classes de ce type de protéines est la superfamille des facilitateurs majeurs (MFS, Major Facilitator Superfamily), qui se retrouve dans tous les domaines de la vie et s'est diversifiée en de nombreuses familles, possédant différentes spécificités par rapport au substrat. Chez les transporteurs de la MFS, le site de liaison au substrat est situé entre les deux domaines de la protéine, et il est admis que le transport se produit par un « mécanisme d'accès alternatif » où la protéine peut être soit dans un état ouvert vers l'extérieur (site de liaison accessible seulement depuis l'environnement extracellulaire), soit dans un état fermé (site de liaison inaccessible), soit dans un état ouvert vers l’intérieur (site de liaison accessible seulement depuis le cytoplasme). Ainsi, d'après cette hypothèse, la liaison avec le substrat dans l'état ouvert vers l'extérieur est suivie d'un changement de conformation vers l'état fermé, qui empêche le substrat de quitter le site de liaison. Cette étape est suivie d'un autre changement de conformation pour atteindre l'état ouvert vers l'intérieur, ce qui permet de libérer (c'est-à-dire importer) le substrat dans le cytoplasme.
GLUT pour le glucose chez les mammifères…
La famille MFS la plus connue est probablement la famille des transporteurs de glucose chez les mammifères (GLUT). Les transporteurs GLUT 1 à 4 ont été étudiés en détail : GLUT1 est responsable de l'absorption de base du glucose dans la plupart des types de cellules et subit une forte régulation positive dans beaucoup de formes de cancer, GLUT2 est essentiel à la régulation de la sécrétion d'insuline, GLUT3 est responsable (avec GLUT1) de l'absorption de glucose dans le système nerveux central, et GLUT4 est le transporteur de glucose sensible à l'insuline des muscles et des tissus adipeux (graisse du corps).
Pour comprendre le mécanisme de transport des transporteurs de la MFS en général et des transporteurs GLUT en particulier, une équipe du Karolinska Institutet de Stockholm a entrepris de cristalliser l'homologue bactérien de la famille des GLUT des mammifères : le transporteur de xylose XylE de la bactérie Escherichia coli.
… et XylE pour le glucose chez E. coli
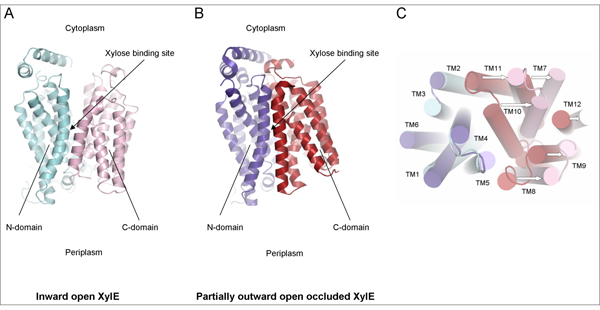
En utilisant des données de diffraction obtenues sur PROXIMA1, les chercheurs ont été en mesure de déterminer la structure cristalline de XylE dans une conformation ouverte vers l'intérieur (Fig. 1A). En comparant cette structure à deux autres structures de XylE, l’une ouverte vers l'intérieur-partiellement fermée (données de diffractions collectées à Diamond, résultats également publiés dans cet article) et l’autre partiellement ouverte vers l'extérieur-fermée (réf.1) (Fig. 1B), il apparaît que le XylE fonctionne par un mécanisme d'accès alternatif et que la transition entre l'état partiellement ouvert vers l'extérieur-fermé et l'état ouvert vers l'intérieur implique un important mouvement de basculement de corps rigide des deux domaines individuels (Fig. 1C).
Quel mécanisme contrôle ces mouvements ? Il apparaît que le contrôle des changements structuraux à la base du cycle fonctionnel est réalisé de différentes manières dans les familles MFS. Toutefois, il est clair que la présence d’un ensemble de’ « acides aminés de signature » cytoplasmiques hautement conservés est essentiel pour cette tâche dans la famille des GLUT des mammifères Ces acides aminés sont également présents dans le XylE, et en comparant les trois structures disponibles il devient clair que la coupure et la reconstitution d'un certain nombre d'interactions ioniques entre les acides aminés de signatures sont cruciales pour contrôler l'accès au site de liaison depuis le cytoplasme.
Conclusion
XylE est le premier transporteur de la MFS dont le fonctionnement a été élucidé dans plus d'un état conformationnel. Ces résultats fournissent ainsi la première preuve structurale directe de la validité de l'hypothèse de l'accès alternatif pour un transporteur de la MFS, et ouvrent des perspectives sans précédent pour une meilleure compréhension du mécanisme de transport par des simulations numériques (dynamique moléculaire). De plus, ces données soulignent l'importance des acides aminés de signature des GLUT pour le contrôle des mouvements de corps rigide qui ouvrent et ferment l'accès au site de liaison depuis le cytoplasme.
Référence 1: “Crystal structure of a bacterial homologue of glucose transporters GLUT1-4”. Sun, L. et al. (2012). Nature. 490:361-366.