Comment la solvatation affecte l'énergie des électrons les plus internes d'une molécule de soluté organique
Dans une solution aqueuse, les molécules de solvant peuvent facilement modifier l'énergie des électrons les plus externes des atomes qui composent un soluté organique, ce qui peut affecter la coloration de cette solution : on parle de « solvatochromisme ». Par contre, l'effet que la solvatation peut avoir sur l'énergie des électrons internes, les plus étroitement liés aux noyaux des atomes, est moins trivial.
Une étude récente, réalisée sur la mélamine en solution aqueuse, a révélé que l'impact du solvant sur les électrons internes dépend fortement de la nature du site chimique où les électrons sont situés et de l’implication éventuelle de ce site dans des interactions spécifiques entre molécules.
L'énergie des électrons les plus proches du noyau, ou électrons internes, de chaque élément (communément nommée « énergie de liaison » entre ces électrons et le noyau) est connue pour être l’"empreinte digitale" des éléments et de leur état chimique, c'est-à-dire leur état d'oxydation. Par conséquent, toute variation de l’énergie de liaison indique un changement chimique, et son étude apporte des informations sur de nombreux processus chimiques. Par exemple, les réactions catalytiques sont de plus en plus souvent étudiées au moyen de la spectroscopie de photoémission des rayons X (XPS). Cette technique permet en effet de mesurer l'énergie de liaison des électrons de du catalyseur - avant, après et même pendant la réaction de catalyse- avec la possibilité d'identifier les sites actifs de ce catalyseur et les intermédiaires de la réaction.
Dans ce contexte, une équipe de scientifiques (Université de Rome, Université de Padoue, Italie ; Institut Ruđer Bošković, Croatie) a choisi d'étudier comment les énergies de liaison d'un photocatalyseur organique sont affectées par son interaction avec l'eau. Le photocatalyseur étudié est la molécule de mélamine (triamino-s-triazine, C3H6N6, voir schéma molécule, cf figure 1), un composé -contenant plusieurs atomes d’azote- qui pourrait éventuellement catalyser la production d’hydrogène H2 à partir d'eau sous irradiation par la lumière UV-visible.
Selon des études théoriques, lors de l'excitation par la lumière un transfert d'électron couplé à un proton se produit depuis la molécule d'eau liée à un H du cycle, coupant l'eau en radical OH et atome H, ce dernier se liant à un azote du cycle. Une manière non ambiguë d'identifier ces espèces chimiques, et ensuite de confirmer le mécanisme de réaction, consisterait à surveiller les variations d’énergie de liaison des électrons de l’élément N de la molécule de mélamine avant, pendant et après irradiation lumineuse.
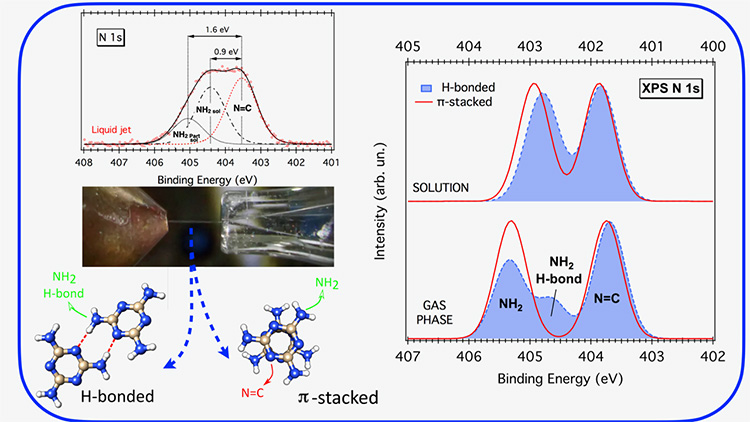
Dans le but d'explorer le mécanisme global de la réaction, l'équipe de recherche a utilisé la technique de spectroscopie XPS par micro-jet liquide disponible sur la ligne de lumière PLEIADES (partie gauche, en haut de la figure 1), pour obtenir la signature des électrons de l’azote dans la molécule de mélamine en juste avant la réaction de catalyse, c’est-à-dire en milieu liquide.
Afin d’appuyer les résultats expérimentaux, les scientifiques ont par ailleurs réalisé une étude théorique en deux étapes. Dans un premier temps, des simulations métadynamiques classiques ont permis d’explorer la manière dont les molécules de mélamine s’auto-associent en solution aqueuse, et d’identifier quelques structures adoptées par la molécule : par empilement (interactions π-π) et/ou avec des liaisons hydrogène (figure 1).
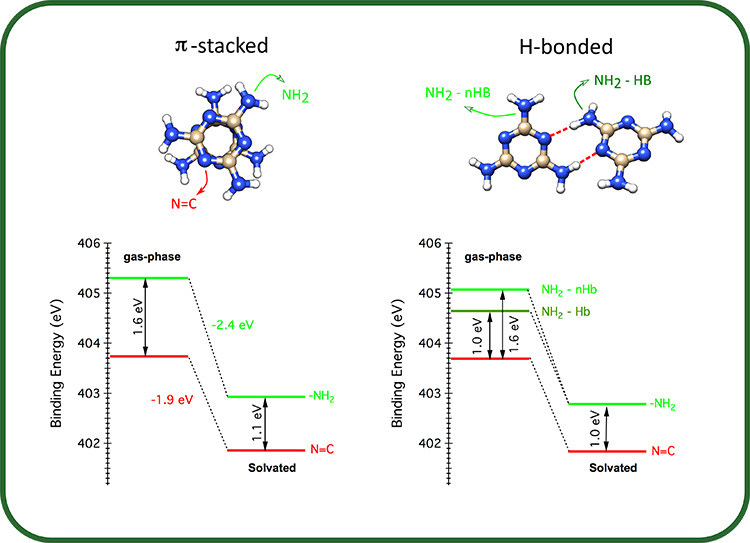
Ensuite, les spectres XPS de l’élément N de la mélamine ont été calculés en phase gazeuse et en phase liquide pour les dimères identifiés lors de la première étape de simulations. Ainsi, l'effet de la solvatation sur chaque type de groupe fonctionnel contenant N (NH2 et N=C) a pu être analysé. Les dimères π-empilés présentent des spectres, presque identiques à ceux du monomère, dans lesquels le déplacement chimique entre les niveaux d’énergie pour le amino-N (NH2) et le triazine-N (N=C) diminue notablement : de ∼1,5 eV en phase gazeuse à ∼1,0 eV en solution (partie droite de la figure 1). Une analyse plus détaillée révèle que, lors de la solvatation, l’énergie de liaison correspondant à chaque type d’atome N de la mélamine diminue, et celle de l’amino-N diminue nettement plus que celle du triazine (partie gauche de la figure 2).
En ce qui concerne les dimères liés par liaisons H, les spectres en phase gazeuse sont sensiblement différents de ceux des dimères empilés π (partie droite, figure 1). De manière surprenante, la solvatation supprime toutes les non-équivalences dues aux liaisons H, ce qui donne des spectres XPS similaires pour tous les dimères (partie droite de la figure 1), correspondant très bien aux spectres expérimentaux.
Les résultats de ce travail montrent que la solvatation de la mélamine dans l'eau a un impact plus important sur les électrons internes situés sur l’azote des groupements NH2 que sur ceux de l’azote des triazines. Cependant, si l'amino-N est impliqué dans des interactions intermoléculaires avec des liaisons hydrogène, l'impact du solvant est réduit par rapport à la configuration sans interaction.