Biologie-Santé : Mécanisme de biosynthèse des clusters fer-soufre dans les cellules
Le fer est un élément essentiel à la vie. Il est utilisé sous forme de groupements fer-soufre comme constituant de sites actifs d’enzymes intervenant dans des processus vitaux tels que le stockage d’énergie en ATP (adénosine triphosphate), la synthèse de constituants cellulaires et le maintien de l’intégrité du génome.
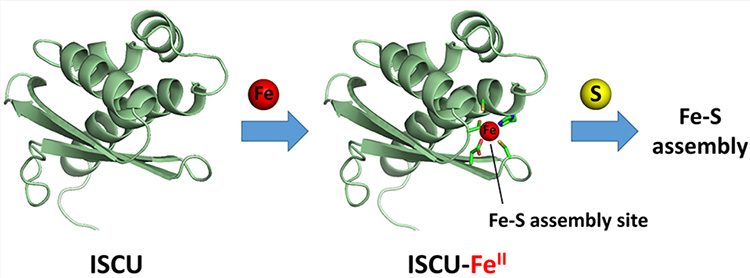
La biosynthèse des clusters fer-soufre est un processus complexe encore très mal connu. De plus, un certain nombre de maladies sont causées par un défaut dans ce processus. Il est donc important de mieux connaitre le mécanisme d’assemblage de ces clusters. L’étude présentée ici a permis de déterminer la première structure du site à fer dans la protéine plateforme qui assure l’assemblage de ces clusters.
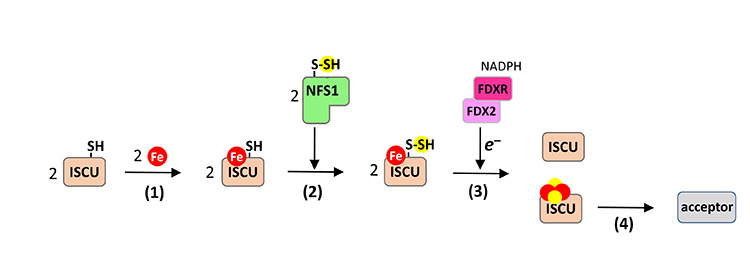
Les centres fer-soufre (Fe-S) sont des assemblages polynucléaires d’ions fer et sulfure constituant les sites actifs d’un très grand nombre d’enzymes intervenant dans une multitude de processus biologiques essentiels. Les centres Fe-S sont biosynthétisés sous formes [2Fe2S] et [4Fe4S] par des machineries multi-protéiques spécialisées et sont ensuite insérés dans les protéines cibles. Le processus de biosynthèse est réalisé en plusieurs étapes dont la plupart sont encore très mal connues (Fig. 1).
Dans une étude précédente, les scientifiques de l’I2BC, de l’ICSN et de l’Université Kaiserslautern participant à l’étude décrite ici ont montré que, dans la protéine ISCU de souris - plateforme d’assemblage des centres Fe-S - la fixation du fer est l’étape précédant l’insertion du soufre (Fig. 1, étape 1).
Leurs mesures par spectroscopies Mössbauer et d’absorption électronique avaient montré que le fer se fixe sous forme ferreuse (Fe2+) via plusieurs atomes de soufre provenant d’acides aminés cystéine de la protéine ICSU. Le site d’assemblage des centres Fe-S contient trois cystéines ainsi qu’une histidine et un aspartate, qui sont des acides aminés strictement conservés entre espèces. La protéine ISCU de souris possède également une quatrième cystéine mais celle-ci n’appartient pas au site d’assemblage et n’est pas conservée entre espèces. Par ailleurs, leurs études par mutagénèse dirigée avaient permis de conclure qu’au moins trois acides aminés du site d’assemblage de ICSU sont impliqués dans la fixation du fer : l’aspartate et deux des cystéines (n°35 et 61). Les chercheurs ont donc émis l’hypothèse que le fer se fixe dans le site d’assemblage. Mais la structure complète du site restait à déterminer.
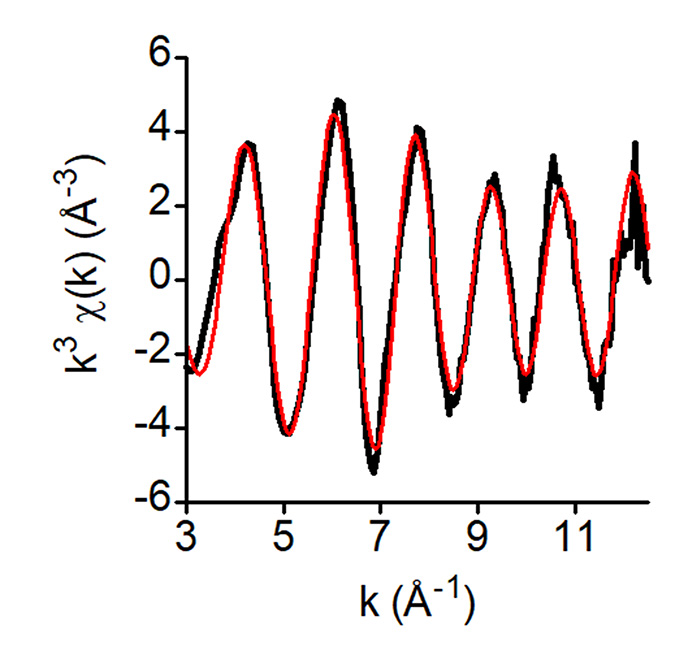
Leurs mesures par spectroscopie d’absorption des rayons X sur la ligne SAMBA ont permis de montrer que le fer se lie à ICSU dans un site contenant des cystéines et a permis de déterminer la première structure du site à fer de la protéine ISCU de souris. D’après l’analyse des données d’EXAFS, le fer est sous forme mononucléaire lié par quatre atomes : deux soufres et deux azotes et/ou oxygène (Fig. 2).
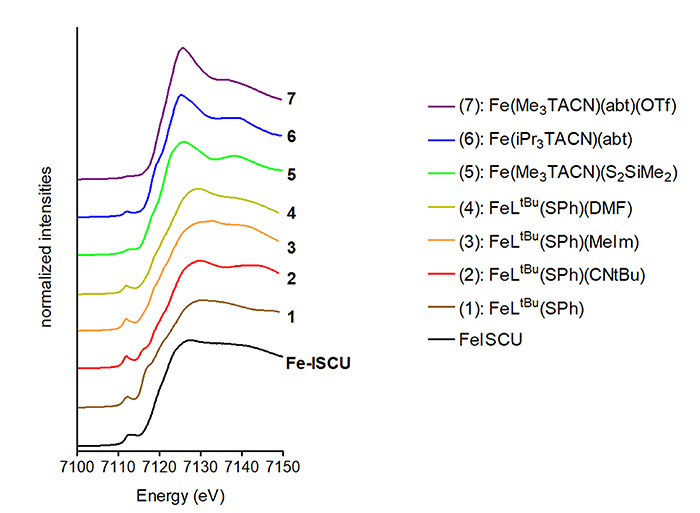
L’analyse des données de XANES et la comparaison avec des complexes à fer modèles ont montré que le fer se trouve dans un environnement tétraédrique lié à quatre ligands, en accord avec les données EXAFS (Fig. 3).
Ces données ont permis aux chercheurs de proposer une structure du site de fixation du fer composé de 2 cystéines (Cys35 et Cys61), un aspartate (Asp 37) et une histidine (His103), disposés selon une géométrie tétraédrique.
Grâce à l’ensemble de ces résultats, il apparait que le fer se fixe dans le site d’assemblage pour initier l’assemblage des clusters Fe-S. La détermination de la structure du site à fer par spectroscopie d’absorption X ouvre aujourd’hui la possibilité d’étudier plus finement le mécanisme d’insertion du soufre et au final de formation des centres Fe-S.